
Egy ételrecept kipróbálásánál idônként megváltoztathatunk egy-egy komponenst. Ugyanígy a számítógépes modellezés is lehetôvé teszi, hogy a kutatók több száz mutációt is megvizsgáljanak – anélkül, hogy ténylegesen elkészítenék ôket. A szimulációban kapott fontosabb eredmények késôbb a laboratóriumban ellenôrizhetôk.
Ha az emberi szerv minden egyes sejtje ugyanazt a genetikai információt tartalmazza, akkor miért állítanak elô különbözô fehérjéket? Például miért állít elô a hasnyálmirigy inzulint, a májsejtek pedig epét?
Bár a válasz nagy vonalakban már évtizedek óta ismert, egyes fontos kérdések megválaszolásán még ma is dolgoznak. A fehérjeépítéshez szükséges információt a DNS-bôl álló gének hordozzák. De mi aktiválja ezeket az utasításokat? A hatvanas évek vége óta a kutatók már tudják, hogy egyes fehérjék molekuláris kapcsolóként mûködnek, azaz a DNS-hez kötôdve elindítják vagy épp leállítják a megfelelô fehérjék elôállítását.
Bruce Tidor, biofiziko-kémikus három éve tanulmányozza ezeknek a génkapcsolóknak az egyik nagy csoportját. Ezen csoport fehérjéi úgy jönnek létre, hogy két különálló fehérje cipzár módjára egymáshoz tapad, egy dimert (kételemû egységet) képez. Mivel a két fehérjét összefogó cipzár fogai sokszor a leucin nevû aminosavból állnak, ezt a mintázatot leucin-cipzár néven is ismerik.
Tidor – a cambridge-i Whitehead Institute for Biomedical Research munkatársa – szerint ezeknek a leucin-cipzáraknak a tanulmányozása alapvetô információkat nyújt a fehérjéket összetartó erôkrôl, valamint segít megérteni a rák molekuláris mechanizmusát. Úgy tûnik, hogy ezek a leucin-cipzárak fontos szerepet játszanak két ismert onkogén – rákot okozó gén – mûködésében. Egyes kutatók úgy vélik, hogy akkor alakul ki rák, ha a leucin-cipzárak mutációja abnormális dimert hoz létre. Így a leucin-cipzárak struktúrájának pontosabb ismerete hatékonyabb rákgyógyszerek tervezését segítheti elô.
Tidor a Pittsburgh Supercomputing Center CRAY C90-es gépén vizsgálta, hogy a fehérje szerkezetének kis változásai hogyan befolyásolhatják a fehérje szerepét. A számítógépes modellezésnek ez a fajtája olyan, mintha egy új receptet anélkül próbálnánk ki, hogy valóban megfôznénk az ételt, igy több évnyi labormunkát lehet vele megtakarítani. Tidor ezekkel a kutatásokkal új információkat szerzett arról, hogy a két fehérjemolekula hogyan kapcsolódik egymáshoz a leucin-cipzár keletkezése közben.
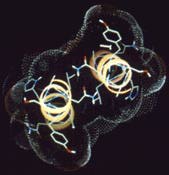
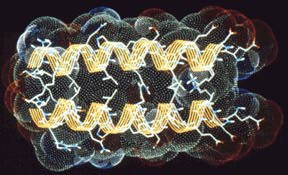
A leucin-cipzár két hélixe (jobb oldali kép – felülnézet, bal oldali kép – oldalnézet) sárga csíkozott szalagokként körvonalazódik. Mint a felülnézeti ábrán jól látszik, ezek a szalagok gyengéden körülölelik egymást. A vonalas ábra a molekuláris struktúrát jelzi – az oxigén piros, a nitrogén kék, a hidrogén fehér, a szén zöld. A pöttyözött felület a molekula azon részét mutatja, amelyik érintkezhet az ôt körülvevô vízzel. Mint az a felülnézeti ábrán látszik, ez a felület leárnyékolja a két hélix közti területet, így a víz nem hatolhat be oda, ahol a cipzárat alkotó leucin és a többi hidrofób molekula helyezkedik el.
[ Vissza a válogatás listájára ]