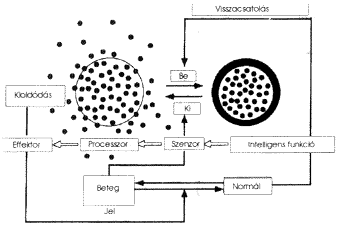
4. ábra. Szabályozott hatóanyag-ellátás
intelligens géllel
Zrínyi Miklós
A szintetikus izom és szabályozott hatóanyag-leadás
A szabályozott hatóanyag-leadás új módszerei
Az élôvilág csodálatos képessége a homeosztázis, amely a szervezet környezeti hatásokat érzékelõ képességének, valamint az ezekre adott hatékony reakciók páratlan összjátékában mutatkozik meg. A homeosztázis következménye, hogy az élô szervezetben a hômérséklet, a nedvek pH-ja és összetétele közel állandó értéket mutat. A betegség egyik következménye a homeosztázis megbomlása, amikor a szervezet már nem képes az egészséges mûködési feltételeket biztosítani, ehhez külsô beavatkozásra van szükség. Ennek leggyakoribb módja a gyógyszeres kezelés. A hatékony gyógyszeres terápiának Iegalább három fontos kívánalmat kell kielégítenie. Olyan molekulát kell találni, amely gyógyító hatású. Ez a munka a szerves kémikus, a biokémikus és a gyógyszerész cseppet sem könnyû feladata. Ha a hatóanyaggal már rendelkezünk, akkor azt a megfelelô helyre kell eljuttatni, továbbá folyamatosan biztosítani kell a hatóanyag optimális koncentrációját a gyógyulási folyamat során. Ismert, hogy a méregdrága gyógyszer-hatóanyagoknak csak egy igen kis hányada jut el oda, ahol hatnia kell, nagyobb mennyisége kárba vész vagy nemkívánatos változásokat okoz az egészséges helyeken. A hagyományos módszer ezért pazarló.
Sokszor fontos követelmény még, hogy a "célba juttatott" hatóanyag koncentrációja csak megfelelô értékek között változhat. A kívánatosnál nagyobb mennyiségû hatóanyag ugyanis toxikus hatást is kifejthet. A minimális koncentrációnál kisebb mennyiség pedig ismét kárba vész. Ezek a követelmények sem teljesíthetôk maradék nélkül a hagyományos eljárásokkal. A szájon történô hatóanyag-bejuttatás során a hatóanyag koncentrációja a vérben hirtelen eléri a maximális értékét, majd fokozatosan csökken. Az intravénás megoldás általában a hatóanyag-koncentráció exponenciális csökkenését okozza. Az említett módszerek egyikével sem valósítható meg az, hogy a hatóanyag mennyisége hosszabb ideig is a gyógyuláshoz szükséges optimális koncentráció tartományában maradjon. E problémák megoldásához új eljárások kidolgozására és új gyógyszerhordozók elôállítására van szükség. Ebben a munkában a fô szerep a fiziko-kémikusnak és a gyógyszertechnológusnak jut.
Az új módszerek kidolgozása már megkezdõdött. Polimergélek térfogatának a környezeti paraméterekkel elõidézett befolyásolása megteremtette a szabályozott gyógyszerhatóanyag-leadásnak egy teljesen új lehetôségét. Az új típusú hatóanyagleadás sok szempontból hasontít az élô szervezetek homeosztázisához, mivel a polimergélek rendelkeznek az érzékelés képességével. A környezettel való termodinamikai egyensúly felelôs a gél koncentrációjáért, azaz térfogatáért, ami döntô módon meghatározza a kioldódás kinetikáját.
Képzeljük el, hogy a hatóanyagot kisméretû gélgömbökbe "csomagoljuk", azaz a polimeroldatot a hatóanyag jelenlétében gélesítjük. A gélesítés a polimerláncok kémiai kötésekkel történô összekapcsolását jelentí. A térhálósítás mértékének megfelelõ megválasztásával elérhetô egy olyan állapot, amelynél a hatóanyag mérete jóval kisebb, mint a hálóláncok közötti átlagos távolság. Ebben az esetben a hatóanyag gélbôl történô kioldódásának nincsenek geometriai korlátai. Tételezzük fel, hogy a gélgömbök térfogatát a hômérséklet kismérvû megváltoztatásával jelentôs mértékben növeljük, azaz külsô hatással duzzadást idézünk elô. Ha a mikrogéIgömböket, például a hômérséklet emelésével, duzzadásra késztetjük, akkor a térfogatváltozással arányos módon növekszik a hálóláncok közötti távolság, melynek következtében a gélbe zárt hatóanyag kioldódásának már nincsenek geometriai akadályai, így ennek kioldódási sebessége jelentõsen megnô. A fordított eset is megvalósítható, amikor a gél térfogatát a gélkollapszus elôidézésével csökkentjük. A térfogatváltozás következménye kettõs. Egyrészt a hálóláncok közötti átlagos méret jelentõsen csökken, ami komoly geometriai korlátozást jelent a mobil komponensek kioldódására. A gélkollapszus másik velejárrója, hogy a gélgömbök felülete "bôrösödik", ami szintén lassítja a kioldódásí folyamatot. Mivel a gél termodinamikai állapotát a környezetének összetétele is meghatározza, ezért, ha a kioldódott hatóanyag koncentrációja egy kritikus érték alá csökken, akkor a gél ismét a nagyobb duzzadásfokú állapotába jut, utat engedve a hatóanyag további kioldódásának. Az intelligens hatóanyag-leadás sémáját a 4. ábra szemlélteti [19].

4. ábra. Szabályozott hatóanyag-ellátás
intelligens géllel
Kétféle külsô szabályozási lehetõséget különböztethetünk meg: a fizikait és a kémiait. A fizikai módszerek közül a hômérséklet-változással elôidézett kollapszus hatása a hatóanyag-kioldódásra az egyik legtöbbet vizsgált kutatási terület. A hatóanyagot hordozó gél kémiai szerkezete alapján beszélhetünk pozitív, valamint negatív hõmérséklet-érzékenységrôl. A részlegesen hidrolizált poliakrilamid pozitív hõmérséklet-érzékenységet mutat, mert a gél térfogata a hômérséklet növelésével nõ. Negatív hômérséklet-érzékenységet mutat a NIPA-gél, mert a térfogata a hõmérséklet növelésével csökken. A pozitív hõmérséklet-érzékenységet mutató géleknél a kioldódás a hômérséklet csökkentésével állítható le, míg a negatív érzékenységet mutató géleknél ez a hômérséklet emelésével valósítható meg: A néhány fokos hõmérseklet-változással jelentôs hatás érhetõ el.
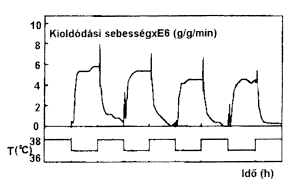
Az 5. ábrán látható az indometacin modellanyag
NIPA-alapú kopolimer gélbõl történô
kioldódásának kinetikája. A kioldódás
sebessége nagymértékben befolyásolható
a hõmérséklettel. A negatív érzékenységet
mutató gélbõl 36 fokon jelentôs a kioldódás,
míg ez 38 fokon igen kismérvûvé válik.
A gél hômérsékletének változtatásával
lehetõség adódik a gyors és lassú kioldódási
szakaszok váltogatására. Nagy intenzitással
folynak a kutatások pozitív érzékenységet
mutató gélrendszerek kifejlesztésére.
A kioldódás kinetikája a pH változtatásával
is szabályozható. Anionos hidrogélek duzzadásfoka
savas közegben kicsi, a pH növelése a semleges értékig
maga után vonja a duzzadásfok jelentôs növekedését,
ami felgyorsítja a kioldódási folyamatot.
 |
 |
| 5. ábra. Az idometacin kioldási sebességének
hõmérsékletfüggése |
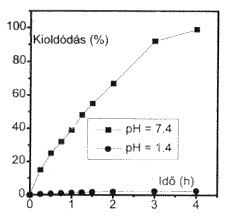
6. ábra. A lizozim kioldódásának kinetikája
eltérô pH-jú poIimer gélbôl |
A 6. ábra mutatja a lizozim fehérje kioldódásának kinetikáját foszforsav-csoportokat tartalmazó polimergélból. Az ábrán jól látható, hogy a pH 1,4-rôl 7,4-re történô emelése sokszorosára növeli a lizozim kioldódásának sebességét.
A gél térfogatával szabályozott hatóanyag-kioldódás humán alkalmazását megnehezíti a hômérséklet vagy a pH változtatásának technikai problémája. Más megoldás, mint például elektromos tér alkalmazása, veszélyessége miatt kisebb jelentôségû.
A hatóanyag-kioldódás kémiai szabályozása az eddigieknél is izgalmasabb terület. Ennek egyik szép példája a glükózérzékeny gél. Ez a gél mint egy mesterséges hasnyálmirigy gondoskodik a vér glükózkoncentrációjának megfelelõ értéken tartásáról. A szervezetben, a hasnyálmirigyben képzõdõ inzulin állítja be a glükóz koncentrációját a kívánatos 70–110 mg/100 cm3 értékekre. Cukorbetegek a szükséges inzulint injekcióval kapják. Igen nagy veszély forrása az inzulin túladagolása, ami tragikus következményekkel is járhat. Japán kutatók már eddig is több olyan gélrendszert fejlesztettek ki, amelyeknek inzulinleadó képessége a környezetben lévô glükóz koncentrációjától függ. Ezek közül most egyet mutatok be.
Az inzulint olyan gélbe zárják, amelynek hidroxilcsoportokat
tartalmazó polimerláncai borátionokat tartalmaznak
kisebb mennyiségben. A borátionok szerepe kettôs, egyrészt
a szomszédos láncokon lévô OH-csoportokkal kötéseket
alakítanak ki. E keresztkötések számától
függ az inzulin kioldódásának lehetôsége.
Ha sok keresztkötés alakul ki, akkor a sûrû molekuláris
hálózat megakadályozza az inzulin eltávozását.
A borátionok nemcsak a polimerláncokon lévõ
OH-csoportokkal, hanem a glükóz OH-csoportjaivaI is komplex
kötéseket létesíthetnek. Ráadásul
a glükózzal kialakított kötések erôsebbek,
így a polimerlánc és a glükóz borátionokkal
történô reakciójának versengésébôl
a glükóz kerül ki gyõztesen. Ennek következtében
a térhálósítás mértéke
csökken, ami maga után vonja a gél térfogatának
növekedését, ezzel együtt pedig megindul az inzulin
kioldódása. A glükózérzékeny gél
mûködését a 7. ábra szemlélteti.
A laboratóriumi vizsgálatok szerint ez a gél hosszú
ideig képes közel állandó inzulinkoncentráció
biztosítására.
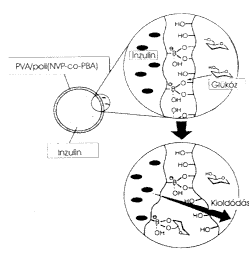 |
 |
| 7. ábra. Szabályozott inzulinleadás
glükózérzékeny géllel |
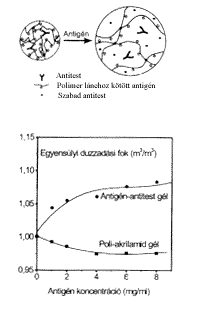
8. ábra. Antigénérzékeny gél
duzzadásfokának változása |
A kémiai környezet által szabályozott térhálósságú gélek egy másik csoportját alkotják az antigénérzékeny gélek [20]. Ezek polimerláncai olyan antitesteket tartalmaznak, amelyek a polimerláncokhoz kötött antigénekkel képeznek másodlagos kötéseket. Ezek a hídkötések a gél térhálósságának mértékét növelik. Ha a duzzasztó folyadék szabad antigén részecskéket tartalmaz, akkor megindul a verseny a szabad és a polimervázhoz kötött antigének között az antitestekért. Amilyen mértékben szorítja ki a szabad antigén a vázhoz kötöttet, olyan mértékben csökken le a térhálósító keresztkötések száma. Ennek pedig közvetlenül érzékelhetô hatása a gél térfogatának növekedése. A gél térfogata tehát a környezetében lévô antigén részecskék koncentrációjától függ. Ellentétben az antitestet nem tartalmazó géllel, az antigénérzékeny gél térfogata az antigén koncentrációjának növelésével nõ, ahogy ezt a 8. ábra mutatja.
A környezeti hatásokra érzékeny gélek, a biológia és az orvos-biológia más területén is új lehetôségeket nyithatnak meg. A gél térfogatának nagymérvû megváltozása a hidrofil és hidrofób csoportok egymással versengõ kölcsönhatásainak következménye. A külsõ hatással kiváltott átmenet jelentõsen befolyásolja a gél felszínének adhéziós tulajdonságait. Ez utóbbi pedig fontos tényezôje sejtkultúrák és szövettenyészetek elõállításának.
A szerzõ reményei szerint a dolgozatban bemutatott példák
jól tükrözik, hogy a lágy polimerrendszerek különleges
tulajdonságai – például a környezethez való
alkalmazkodóképessége – megteremtették egyes
biológiai folyamatok utánzásának [mímelésének]
lehetõségét. Ezzel együtt talán megszületett
a biológiai kémia, amely szupramolekuláris szervezetek
kémiai és fizikai-kémiai kölcsönhatásávaI
törekszik biológiai funkciókat megvalósítani.
IRODALOM
1. M. V. Gandhi, B. S. Thompson: Smart Materials and Structures, Chapman
& Hall (1992)
2. Zrínyi M.: Magyar Tudomány, 6. sz. (1999)
3. V. A. Engelhardt, M. N. Ljubimova: Nature, 144, 668 (1939)
4. W. Kuhn: Experientia, 5, 318 (1948)
5. A. Katchalsky: Experientia, 5, 319 (1949)
6. Kuhn, B. Hargitay, A. Katchalsky. H. Eisenberg: Nature, 165. 514
(1950)
7. A. Katchalsky: Journal of Polymer Science, 7, 393 (1951)
8. W. Kuhn. A. Ramel, D. H. Walters: Size and Shape Changes of Contractile
Polymers, Ed. A. Wasserman, Pergamon Press (1960)
9. A. Katchalsky: Proceedings of the 4th International Congress on
Pharmacology, Basel. Vol. l (1969)
10. Tatara: Bulletin J.S.M.E., 15, 58 (1972)
11. Tanaka: Phys. Rev. Lett., 40, 820 (1978)
12. Hunkawa, T. Tanaka: J. Chem.Phys., 81, 6379 (1984)
13. Sumemoto: Polymer Gels, Plenum Press, New York (1991)
14. H. Okuzaki, Y. Osada: J. Biomater. Sci., Polym. Eds., 5, 485 (1994)
15. M Shahinpoor: Journal of Intelligent Material Systems and Structures,
6, 307 (1995)
16. R.Yoshida, T. Takahashi, T. Yamaguchi, H. Ichijo: J. Am. Chem.
Soc., 118, 5134 (1996)
17. Zrínyi M., Gács J., Simon Cs-né: 213 215 sz.
Magyar Szabadalom
18. M. Zrínyi: Trends in Polymer Sciertce, 9. 277 (1997)
19. Yoshida, K. Sakai, T. Okono, Y. Sakurai: Advanced Drug Delivery
Reviews, 11, 85 (1993)
20. T. Miyata. N. Asami. T. Uragami: Proc. Fourth International Conference
on Intelligent Materials, 206 (1998)
| Kémia az ezredfordulón | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |