A szteroid mag konformációja[1]
D. H. R. Barton[2], Cambridge, Mass.
Experientia, 6, 316 (1950)
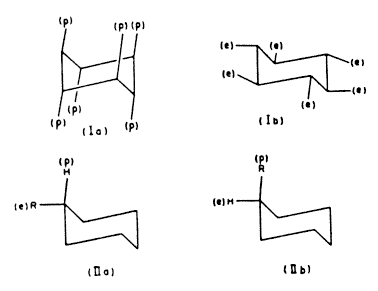
Az utóbbi években általánosan elfogadottá vált, hogy a ciklohexán szék konformációja jelentôsen stabilabb a kádnál. A szék konformációban [3,4] kétféle szén–hidrogén kötés különböztethetô meg; azok, amelyek – mint az (Ia) ábrán – merôlegesek a lényegében hat szénatomot tartalmazó síkra, és amelyeket polárisnak (p) hívnak[3]; valamint azok, amelyek – mint az (Ib) ábrán – közelítôleg merôlegesek erre a síkra. Ezeket ekvatoriálisnak (e) nevezik[3].

HASSEL és munkatársainak[5,6] híres kísérletei, amelyek során a ciklohexán-származékok elektrondiffrakcióját vizsgálták, új megvilágításba helyezték a sztereokémiának ezeket a finom részleteit. Kimutatták[5] például, hogy a monoszubsztituált ciklohexánok inkább az ekvatoriális (IIa) konformációt veszik fel, mint a poláris (IIb)-t. Ez fontos megfigyelés, mert jelzi, hogy az ekvatoriális konformációk termodinamikailag stabilabbak, mint a polárisak. Talán itt kell rámutatnunk arra, hogy bár a molekula egyik konformációja stabilabb, mint a többi lehetséges konformáció, ez nem jelenti azt, hogy a molekulának úgy kell reagálnia, mintha ezt a konformációt venné fel, vagy mintha bármi módon merevvé válna. Ha a konformációk közötti energiagátak kicsik, a sztereokémia klasszikus módszereivel nem különböztethetôk meg a különbözô konformációk. Másrészt, ha két lehetséges konformáció között van egy kevés szabadenergia-különbség (szobahômérsékleten kb. egy kilokalória), a fizikai vizsgálómódszerek és a termodinamikai megfontolások szerint a molekula lényegében csak egy konformációban jelenik meg.
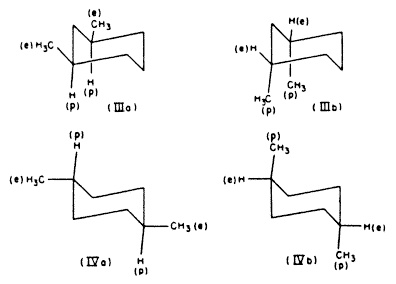
Az ekvatoriális konformációk mind a cisz-1:3-, mind a transz-1:4-diszubsztituált ciklohexánokban stabilabbak a polárisaknál[7]. Így a cisz-1:3-dimetil-ciklohexán inkább a (IIIa) diekvatoriális konformációt veszi fel, mint a (IIIb) dipolárisat, míg a transz-1:4-dimetil-ciklohexán inkább (IVa), mint (IVb) konformációjú.
A termodinamikai számítások szerint[7] a transz-1:2-dimetil-ciklohexán inkább diekvatoriális konformációt vesz fel (V; R=CH3), mint dipolárist (VI; R=CH3). A cisz-1:2-diszubsztituált ciklohexánok esetében két konformáció lehetséges. Az egyik szubsztituens mindkét esetben ekvatoriális, a másik poláris kötést létesít. Mivel az ekvatoriális és poláris konformációk közötti termodinamikai stabilitáskülönbségek feltehetôen sztérikus eredetûek[7]; logikusnak tûnik, hogy a nagyobb szubsztituens képezze az ekvatoriális kötést.
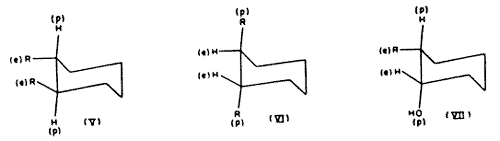
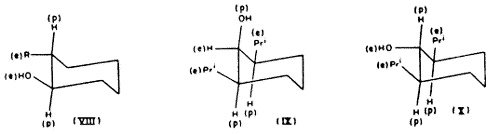
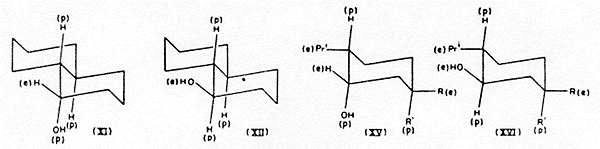
Ugyanez a megfontolás a 2-szubsztituált ciklohexanolokra is kiterjeszthetô. Így[8,9] a cisz-alkoholok (VII; R=alkil) ekvilibrációkor, nátriummal hevítve, majdnem kizárólag transz-izomerekkék alakulnak át (VIII; R=alkil). Az elsô esetben az egyik szubsztituens poláris, a másik ekvatoriális; az utóbbiban mindkettô ekvatoriális. Ugyanilyen relatív stabilitások adódnak a termokémiai adatokból[10]. A két ekvatoriális és egy poláris szubsztituenst tartalmazó 2:6-diszubsztituált ciklohexanol (IX) ekvilibrációkor – hasonlóképpen – (X)-zé izomerizálódik[11]. Ugyanez a helyzet[9] a kétgyûrûs transz-a -dekalollal: a (XI) izomer ekvilibrációkor (XII)-vé izomerizálódik.
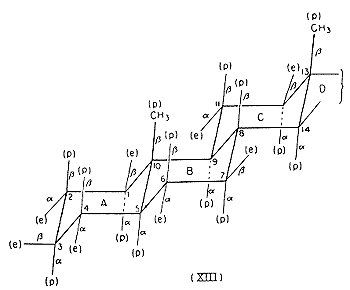
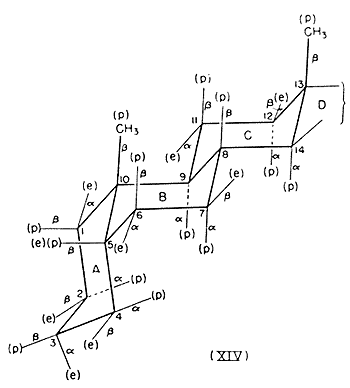
Érdemes megvizsgálni a (XIII) és (XIV) konformációkat[12], amelyeket a szteroid mag vesz fel, amikor az A/B gyûrûkondenzáció transz, illetve cisz helyzetû, mert kiválóan illusztrálják a poláris és ekvatoriális kötések koncepciójának hasznos voltát. A FIESER-féle[13] a- és b-nómenklatúra, valamint poláris és ekvatoriális kötések kapcsolatát szintén feltünteti a (XIII) és (XIV) ábra.
Termodinamikai megfontolások. Számos esetben végrehajtották a szteroid mag szekunder pozícióiban levô hidroxil-csoportok ekvilibrációját. Más pozíciókban a megfelelô ketonokat redukálták nátriummal és alkohollal; errôl a folyamatról megalapozottan állítható, hogy (ciklohexán-származékok esetében) ugyanolyan arányban termeli a termodinamikailag stabilabb alkoholokat, mint az ekvilibrációs kísérletek[14]. Látható tehát, milyen jól érvényesül a stabilabb ekvatoriális konformáció elve. Az I. táblázat jelzi, hogy a várható viszonyok figyelhetôk meg. A táblázat utal az 5a:6b -dibróm-kolesztán ekvilibrációjára az 5b:6a-izomerrel, ami ugyancsak releváns a tárgyalt probléma szempontjából.
I. táblázat
| Tapasztalat | Kísérleti módszer |
| Kolesztán-sorozat A 2 a (e) stabilabb, mint a 2 b (p) A 3 b (e) stabilabb, mint a 3 a (p) A 4 a (e) stabilabb, mint a 4 b (p) A 6 a (e) stabilabb, mint a 6 b (p) A 7 b (e) stabilabb, mint a 7 a (p) Az 5 b (e,p) 6 a (e)-dibromid stabilabb, mint az 5 a (p), 6 b (p)-dibromid |
A 2-on redukciója Ekvilibráció A 4-on redukciója A 6-on redukciója A 7-on redukciója Ekvilibráció |
| Koprosztán-sorozat A 3a (e) stabilabb, mint a 3 b (p) A 11 a (e) stabilabb, mint a11 b (p) A 12 b (e) stabilabb, mint a 12 a (p) Az eredeti cikk táblázatának hivatkozásait elhagytuk (szerk.) |
Ekvilibráció Ekvilibráció Ekvilibráció |
Elimináció. Azoknak a reakcióknak, amelyek mechanizmusához összehangolt 1:2-elimináció szükséges, könnyebben kell lejtszódniuk, ha mind a négy centrum (a két szénatom és a két szubsztituens) egy síkban fekszik. A ciklohexán-származékok összehangolt ionos eliminációikor mindkét szubsztituens optimális – minimális aktiválási energiát igénylô – elrendezése poláris[15,16]. Az irodalomban számos bizonyíték található erre. Így például [19] a cisz-2-szubsztituált ciklohexanolok (VII) sokkal könnyebben hajlamosak a savkatalizált dehidratálásra [H(p) és OH(p) eliminációjára], mint a transz-izomerek (VIII). A mentol-sorozatban [20] a neomentol (XV; R=CH3, R’=H) könnyebben veszít vizet, mint a mentol (XVI; R=CH3, R’=H), és a neoizomentol (XV; R=H, R=CH3) könnyebben dehidratálódik, mint az izomentol (XVI; R=H, R=CH3) [21]. A szteroid vegyületek körében számos érdekes eset illusztrálja ezt a jelenséget. A II. táblázatban több példa is látható.
II. táblázat
| Példák a könnyû eliminációra |
| Kolesztán-sorozat 6 b-OH (p) és 5a-H (p) 6 b-H (p) és 5a-Cl (p) 6 b-Br (p) és 5a-Br (p) 7 a-OH (p) és 8 b-H (p) Koprosztán-sorozat 7 a-OH (p) és 8 b-H (p) 11 b-OH (p) és 9 a-H (p) 11 b-Br (p) és 9 a-H (p) |
| Az eredeti cikk táblázatának hivatkozásait elhagytuk (szerk.) |
Sztérikus gátlás. Régóta ismert, hogy a konfiguráció megállapításában felhasználható a sztérikus gátlás hatása, bár ezek a konfiguráció-asszignációk nem mindig megbízhatóak[22]. Úgy tûnik, hogy ciklohexán-származékok esetében a sztérkus gátlás számos jelenségének relatív nagysága megmagyarázható azon az alapon, hogy a poláris kötések gátoltabbak, mint a megfelelô ekvatoriális kötések. A modellek vizsgálata ezt támasztja alá, mert a poláris kötések a térben mindig közel vannak két másik poláris kötéshez, amelyektôl csak egy szénatom választja el ôket, míg az ekvatoriális kötések esetében nem áll fenn hasonló kapcsolat.
Ezt az általánosítást támasztja alá[23], hogy a cisz-2-szubsztituált, poláris hidroxilokat tartalmazó ciklohexanolokat (VII) nehezebb észteresíteni és észtereiket nehezebb hidrolizálni, mint a megfelelô transz-alkoholokat és észtereiket. Ugyanezt a jelenséget figyelték meg a transz-a-dekalol esetében is[24]. A (XI; poláris hidroxilt tartalmazó) alkohol észtereit nehezebb hidrolizálni, mint a (XII; ekvatoriális hidroxilt tartalmazó) alkohol észtereit. A mentol-sorozatban[25] a mentol (XVI; R=CH3, R’=H) sokkal könnyebben észteresíthatô, mint a neomentol (XV; R=CH3, R’=H); hasonló összefüggés mutatható ki az izomentol (XVI; R=H, R’=CH3) és a neoizomentol (XVI; R=H, R’=CH3) esetében.
Fordított hatás érvényesül azonban[26] a 2-szubsztituált ciklohexanolok krómsavas oxidációjakor. Ekkor a cisz-alkoholok gyorsabban oxidálódnak, mint a transz-izomerek. Ezt a megfigyelést megfelelôen magyarázza a jelen elmélet, ha a sebességmeghatározó lépés nem a szén–hidroxil kötésre, hanem a szén–hidrogén kötésre ható támadás.
A szteroidok esetében kialakuló helyzetet a III. táblázat összegzi. A gátlás várható rendje minden esetben jónak bizonyul. Az adatok között szerepel az alkoholok oxidációja Br+-mal, amely a megfelelô ketonokat szolgáltatja. Azzal a feltevéssel, hogy ezeknek az oxidációknak a során a szén–hidrogén kötésre hat támadás, az eredmények egyeznek a táblázatban összegyûjtött többi megfigyeléssel.
III. táblázat
| Tapasztalat |
| Kolesztán-sorozat A 2 b-OH (p) gátoltabb, mint a 2 a-OH (e) A 3 a-OH (p) gátoltabb, mint a 3 b-OH (e) A 6 b-OH (p) gátoltabb, mint a 6 a-OH (e) A 6 a-H (e) könnyebben oxidálható, mint a 3 a-H (p) A 3 b-H (e) könnyebben oxidálható, mint a 3 a-H (p) Koprosztán-sorozat |
| Az eredeti cikk táblázatának hivatkozásait elhagytuk (szerk.) |
Bár a poláris és ekvatoriális kötések fogalma természetesen nem alkalmazható a ciklopentánra, érdemes megjegyezni, hogy a szteroid magban a 17 a-kötés – a hattagú gyûrûvel lejátszódó kondenzáció miatt – poláris kötés jellegû az adott gyûrûhöz képest. A 17 b-kötés a gyûrû C-atomjához képest ekvatoriális jellegû. Ezek a tények összhangban vannak a 17 b-szubsztituensek nagyobb termodinamikai stabilitásával és a 17a-szubsztituensek nagyobb sztérkus gátlásával [27].
Az elv alkalmazása. Jól látható, hogy a konfigurációk asszignálhatók a poláris és ekvatoriális kötések fogalmának bevezetésével. Egy példa már szerepelt az I. táblázatban. Újabb példa a transz-b-dekalol[28]. A stabilabb epimer (op. 75o) hidroxiljának ekvatoriális konformációban kell lennie, mint a (XVII) ábrán; ez összhangban van azzal a ténnyel, hogy észterei gyorsabban hidrolizálnak, mint az epimer (poláris hidroxidot) tartalmazó alkohol észterei. Az alábbiakban újabb példák következnek.
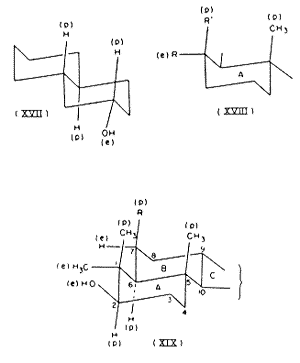
Kiterjesztés a di- és tri-terpenoidokra. Az ekvatoriális és poláris kötések fogalmát ésszerûnek látszik kiterjeszteni más, kondenzált ciklohexán egységekbôl felépülô gyûrûrendszerek sztereokémiai korrelációira is. Így a diterpenoid abietinsav A gyûrûje a (XVIII; R=CO2H, R’=CH3) ábrával reprezentálható[29], amelyben a karboxil ekvatoriális konformációt foglal el. Ekkor érthetô, hogy az abietinsav észtereinek könnyebben kell hidrolizálniuk, mint például a podokarpinsav észtereinek, ahol az A gyûrût a (XVIII; R=CH3, R’=CO2H) írja le, mert az utóbbiban a karboxil a gátoltabb poláris konformációt foglalja el.
Miután ismeretes[30], hogy a triterpenoidok a- és b-amirin-csoportjainak A és B gyûrûi, valamint a lupeol-csoport A és B gyûrûi transz helyzetben kondenzálódnak[31], sztereokémiájukat megkísérelhetjük a (XIX; R=H) ábrával reprezentálni. Az ekvatoriális konformációjú hidroxillal megmagyarázható, hogy a b-amirin-acetát könnyebben hidrolizál, mint az epi-b-amirin-acetát[32], és a lupanol könnyebben hidrolizál, mint az epi-lupanol[33]. Az elrendezés a molekuláris átrendezéskor könnyen lejátszódó víz-eliminációról is számot ad, amelyet foszfor-pentkaloridos kezelés vált ki ezekben a vegyületekben és származékaikban[34]. Ez a reakció összevethetô az izoborneol nagyon könnyû dehidratációjával, amely eredményeként kamfén keletkezik, amennyiben mind a négy atomi centrum, amely a reakció szempontjából fontos, egy síkban fekszik. A szumarezinolsavban levô 7-hidroxil-csoport jelentôs gátlása és könnyû eliminációja savas dehidratáláskor[35] a legjobban úgy magyarázható, ha az a poláris konformáció jelenik meg benne, mint amelyik a (XIX; R=OH) részletben.
A triterpenoidok nómenklatúrájával kapcsolatban célszerûnek látszik a FIESER-féle a-, b-konvenció kiterjesztése a szteroidokra is a triterpenoid sztereokémia leírásához. Alkalmas referenciapont a C5 metil-csoport. Azokat a szubsztituenseket, amelyek a fô gyûrûsíknak ugyanazon az oldalán vannak, mint a metil-csoport, b-konfigurációjúaknak kellene tekinteni, az ellenkezô oldalon levôket a-konfigurációjúaknak. Így a szumarezinolsav neve 2 b : 7 b-dihidroxi-olean-12-én-17-karbonsav lenne.
1 A konformáció szót a kötésben levô atomok valamely együttesének különbözô, feszültségmentes térbeli elrendezéseinek jelölésére használjuk. A klasszikus sztereokémia elveivel összhangban ezeket az elrendezéseket egyféle molekula reprezentálja.
2. Harvard University Visiting Lecturer, 1949-50, Harvard University, Cambridge 38, Mass.
3. C. W. Beckett, K. S. Pitzer, and R. Spitzer, J. Amer. Chem. Soc. 69, 2488 (1947).
4. O. Hassel nómenklatúrája[5] eltérô, de a kétféle típust ugyanúgy különbözteti meg.
5. O. Hassel and H. Viervoll, Acta Chem.Scand. 1,149 (1947).
6. lásd O. Hassel and B. Ottar, Acta Chem. Scand. 1, 929 (1947) összefoglaló dolgozatát és a korábbi munkák hivatkozásait.
7. C. W. Beckett, K. S. Pitzer, and R. Spitzer, J. Amer. Chem. Soc. 69, 2488 (1947).
8. G. Vavon, Bull. Soc. Chim. [4], 49, 937 (1931).
9. W. Hückel, Ann. Chem. 533, 1 (1937).
10. A. Skita and W. Faust, Ber. Dtsch. Chem. Ges. 64, 2878 (1931)
11. G. Vavon and P. Anziabi, Bull. Soc. Chim. [5], 4, 1080 (1937). A többszörösen szubsztituált ciklohexánok konformációjával kapcsolatban említést érdemel, hogy O. Bastiansen, O. Ellersen, and O. Hassel (Acta Chem. Scand. 3, 918 [1949]) újabban kimutatta, hogy az öt sztereoizomer benzol-hexaklorid – elgondolásunkkal összhangban – azokat a konformációkat veszi fel, amelyekben a legnagyobb az ekvatoriális szén–klór kötések száma.
12. A (XIII) és (XIV) konformáció egyértelmûen reprezentálja a szteroid magot, ha fetesszük, hogy A, B és C szék. Ez majdnem biztosan igaz a transz-A/B gyûrûkondenzációra (vö. C. H. Carlisle and D. Crowfoot (Proc. Roy. Soc. A. 184, 64 [1945] röntgediffrakciós adataival, amelyek a koleszteril-jodid konformációjára vonatkoznak), és – legalábbis oldatokban – valószínûleg hasonló monható a cisz-A/B kondenzációra. Az utóbbi igazolása máshol [16,17] részletesen megtalálható. Lásd még Sobotka érvelését[18].
13. L. F. Fieser, The Chemistry of Natural Products Related to Phenanthrene (1st Ed. 1936, Reinhold Publishing Co.)
14. L. 8. és 9.
15. E. D. Hughes and C. K. Ingold et al., J. Chem. Soc. 2117 (1948).
16. D. H. R. Barton and E. Miller, J. Amer. Chem. Soc. 72, 1066 (1950).
17. O. Bastiansen and O. Hassel, Nature, 157, 765 (1946) – O. Hassel and H. Viervoll, Acta Chem. Scand. 1, 149 (1947) és az ott idézett dolgozatok – D. H. R. Barton, J. Chem. Soc. 340 (1948).
18. H. Sobotka, The Chemistry of Steroids, 1938, p. 48 et. seq. (The Williams and Wilkins Co.)
19. 8. G. Vavon, Bull. Soc. Chim. [4], 49, 937 (1931).
20. Összefoglalásként l. J. L. Simonsen and L. N. Owen, The Terpenes, Vol. I (Cambridge University Press, 1947)
21. A szubsztituensek "unimolekuláris" mechanizmussal zajló pirolitikus eliminációja (l. D. H. R. Barton, J. Chem. Soc. 2174 [1949]) rendesen – természetesen – cisz-elimináció, és az itt közölt tárgyalás már nem releváns.
22. W. Hückel, Ann. Chem. 533, 1 (1937). – Vö. az elôzô dolgozattal, amelyben L. F. Fieser intraradiális és extraradiális címszó alatt tárgyalta a sztérikus hatásokat.
23. G. Vavon, Bull. Soc. Chim. [4], 49, 937 (1931).
24. W. Hückel et al., Ann. Chem. 533, 128 (1937).
25. Összefoglalásként l. J. L. Simonsen and L. N. Owen, The Terpenes, Vol. I. (Cambridge University Press, 1947).
26. G. Vavon, Bull. Soc. Chim. [4], 49, 937 (1931).
27. L. F. Fieser, Exper. 6, 312 (1950).
28. W. Hückel, Ann. Chem. 533, 1 (1937). – W. Hückel et al., Ann. Chem. 533, 128 (1937).
29. D. H. R. Barton, Quart. Rev. 3, 36 (1949).
30. D. H. R. Barton, Quart. Rev. 3, 36 (1949).
31. T. R. Ames and E. R. H. Jones, Nature, 164, 1090 (1949).
32. L. Ruzicka and H. Gubser, Helv. chim. acta 28, 1054 (1945); a szerzôk ellentétes konfigurációt adnak meg C2-nél.
33. R. Nowak, O. Jeger and L. Ruzicka, Helv. chim. acta, 32, 323 (1949). Ezekben a vegyületekben a hidroxil-csoport ekvatoriális konformációjára utal az is, hogy a b-amirin termodinamikailag stabilabb, mint az epi-b-amirin (L. Ruzicka and W. Wirz, ib., 24, 248 [1941]).
34. L. Ruzicka, M. Montavon and O. Jeger, Helv. chim. acta 26, 2283 (1943).
| ChemoNet, 1998 Vissza |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |