![]() (33)
(33)
8. A redoxpotenciál
Mint azt az 5. fejezetben megmutattuk, valamely redoxrendszert tartalmazó oldatba merülô nemesfém elektród egyensúlyi potenciálját a 26 egyenlet adja meg. Ebben csak a redoxrendszer tagjainak kémiai potenciálja szerepel, vagyis a redoxelektród potenciálja független az elektród anyagától, sôt, a jelenlététôl is; csak a redoxrendszer anyagi minôségére jellemzô függvény. Az elektródnak csupán annyi a szerepe, hogy mérhetôvé teszi ezt a tulajdonságot. Ez tükrözôdik a 27 egyenletben is, amely szerint az elektródpotenciál az elektronok oldatbeli kémiai potenciáljával arányos mennyiség. Az elektronok oldatbeli kémiai potenciálja ("energiája") pedig a rendszer oxidáló illetve redukáló képességével mértéke: ezt a tulajdonságot fejezi ki az alábbi módon definiált redoxpotenciál is: Egy redoxrendszer e redoxpotenciálja az az egyensúlyi elektródpotenciál, amelyet egy iners fémelektród az illetô redoxrendszerrel érintkezve felvesz. Az
![]() (33)
(33)
egyenlettel jellemzett redoxegyensúly
redoxpotenciálja T hômérsékleten, általánosan:
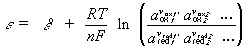 (34)
(34)
ahol e
o a rendszer normál (illetve 25 Co-on a standard)
redoxpotenciálja. Gyakorlati számításokhoz
gyakran alkalmazzuk a 25 Co-ra vonatkozó közelítô
egyenletet, melyben a koncentrációk és aktivitások
közti különbséget elhanyagoltuk:
![]() (35)
(35)
Néhány redoxrendszer e
o normál redoxpotenciálját az utolsó
lapon található táblázat tartalmazza. Mint
a fentiekbôl következik, a skála nullapontja a H2/H+
rendszer standard redoxpotenciálja. A rendszerek többségének
redoxpotenciálja +1 és -1 V között van. Hangsúlyoznunk
kell, hogy
a. A redoxpotenciál az oxidáló (illetve redukálóképesség) mértéke, és mint ilyen, önmagában nem, csak más rendszerek redoxpotenciáljához képest értelmezhetô: mindig a pozitívabb redoxpotenciálú rendszer képes oxidálni a negatívabbat. Általában, minél pozitívabb egy redoxpotenciál, annál oxidálóbb a rendszer.
b. A redoxpotenciál csak a redoxegyensúlyra ad felvilágosítást. Lehetséges, hogy az illetô egyensúly nem valósítható meg, vagy nem áll be reakciósebességi okok miatt.
Számos, vizes oldatban beálló redoxegyensúly pH függô, mert a H+ vagy OH- ionok valamilyen módon szerepelnek az egyensúlyban. Például, a vízbôl történô oxigénfejlôdés egyensúlyát (nem a mechanizmusát!) mindkét alábbi egyenletel jellemezni lehet:
![]() (36)
(36)
![]() (37)
(37)
A redoxpotenciál koncentrációfüggését
megadó 34 egyenletet erre az esetre alkalmazva megmutatható,
hogy a két érték csak a redoxegyensúly felírási
módja miatt különbözik egymástól. Kiindulva
a 35 egyenletbôl, és figyelembe véve, hogy [H+][OH-]=10-14:
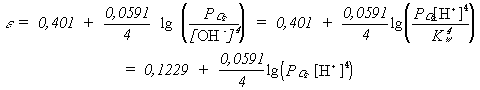 (38)
(38)
azaz a 36 reakcióegyenletnek megfelelô
összefüggéshez jutunk.
A standard redoxpotenciálokat tartalmazó táblázatokon kívül két olyan diagramot szoktunk használni, melyek az egyes oxidációs állapotok stabilitásával kapcsolatosak: az egyik a szabadentalpia - oxidációs állapot diagram, a másik pedig a potenciál - pH diagram (vagy Pourbaix - diagram).
A szabadentalpia - oxidációs állapot diagram a normál redoxpotenciál értékekbôl szerkeszthetô a D G=-nFD E összefüggés alapján. A 2. ábrán látható például a különbözô oxidációs állapotú nitrogénvegyületek képzôdési szabadentalpiája savas illetve lugos közegben. Az ábráról leolvasható például, hogy lugos közegben a N2O4 nem stabil, diszproporcionálódik nitrátra és nitritre; továbbá savas közegben termodinamikai értelemben csak a N2 és NH4+ szpecieszek stabilak.
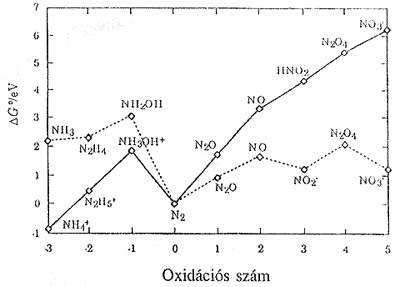
A potenciál - pH (Pourbaix-) diagramok igen hasznosak fém - vizes oldat rendszerek stabilitásának elemzésekor. A 3. ábrán a vas - vizes oldat Pourbaix -diagramját láthatjuk: az egyenes vonalak egy-egy redoxpotenciál - pH összefüggésnek felelnek meg, a vonalak által határolt sokszögek különbözô szpecieszek stabilitási tartományai. Például, az Fe2O3 és Fe3O4 jelû területek olyan potenciál- és pH tartományokat jeleznek, ahol Fe2O3 illetve Fe3O4 jelenléte az uralkodó. Az elválasztó egyenes pedig kijelöli az összetartozó potenciál ill. pH-értékeket, ahol e két vegyület egymással egyensúlyban azonos aktivitású.
2. ábra: A nitrogén különbözô oxidációszámú, oxigénnel és hidrogénnel alkotott vegyületeinek képzôdési szabadentalpiája a N2 képzôdési szabadentalpiájához képest, savas illetve lugos oldatokban (kihuzott ill. szaggatott vonalak). Az eV egységben megadott D Go számértéke megegyezik az illetô redoxreakció V egységben megadott standard potenciáljával.
3. ábra: Vas Pourbaix diagramja vízben, 25 Co-on. Szaggatott vonalak (a és b) jelölik a vízbomlásra jellemzô, a 29 ill. 36 egyenletekkel megadott potenciálokat; a c,d,e és f egyenesek a Fe2+/Fe; a h,i,j és k egyenesek a Fe3+/Fe(OH)2+; az m,n,p és r egyenesek a Fe2+/Fe2O3 illetve a Fe2+/Fe3O4 egyensúlyok potenciálját jelentik rendre 1, 10-2, 10-4 és 10-6 mol/dm3 ionkoncentrációnál.