![]() (29)
(29)
7. Elektródok - példák
A saját ion oldatába merülô fémelektródra jellegzetes példa a már tárgyalt Zn/ZnSO4 (Eo=-0,76 V) és a Cu/CuSO4 (Eo=+0,15 V) rendszerek, de hasonló, gyakorlatban egyszerûen megvalósítható elektród készíthetô számos más fémbôl. Minthogy a redukált állapotú szpeciesz a fém, aminek aktivitása konstans, az elektródpotenciál (adott nyomáson és hômérsékleten) csak a fémionok koncentrációjától (aktivitásától) függ:
![]() (29)
(29)
A redoxelektródok olyan rendszerek, amelyeknél egy redoxrendszer mindkét tagja az oldatban van. Jellegzetes példa egy nemesfém, amely Fe2+ és Fe3+ ionokat (vagy ezek különbözô komplexeit, például Fe(CN)64- és Fe(CN)63- komplexeket) tartalmazó oldatba merül. Számos analóg redoxpár létezik, amelynek tagjai átmeneti fémek ionjai illetve komplex ionjai. Fontosak továbbá a szerves redoxrendszerek is, melyek tagjai az elektrolitban oldhatók, vagy gáz halmazállapotúak.
Általában az elektródpotenciál koncentrációfüggését a 25 egyenlet írja le.
A gázelektródok olyan redoxelektródok, amelynél a redoxpár egyik tagja gáz halmazállapotú, pl. a H2/H+ hidrogénelektród, az OH-/O2 oxigénelektród, a Cl-/Cl2 klórelektród, s.í.t. Ezek az elektródok úgy valósíthatók meg, hogy vizes oldatba (a klórelektród esetében sósavoldatba) nagyfelületû platina vagy palládium elektródot merítünk, és az oldaton a megfelelô, P nyomású gázt buborékoltatjuk át. Ezen elektródok közül a hidrogénelektród jelentôs, minthogy az egységnyi H+ aktivitású, 1 bar nyomású hidrogénnel telített oldatú hidrogénelektród potenciálja definíció szerint 0 V. Egyéb nyomásokon illetve H+ aktivitásoknál a hidrogénelektród potenciálja - minthogy rajta a H2Û 2 H+ + 2 e- egyensúly áll be, és Eo=0 V - a következô képlettel számítható:
 (30)
(30)
Igen stabil és jól reprodukálható potenciálúak azok a fémelektródok, amelyeknél gondoskodunk az állandó fémion-koncentrációról. Ennek egy módja lehet, ha a fémelektródot körülvesszük a megfelelô fémion valamilyen rosszul oldódó sójával, és egy jól oldódó só vizes oldatával. A két só anionja azonos kell hogy legyen. Ilyen pl. a Ag | AgCl/KCl vizes oldat rendszer, az ezüst-ezüstklorid elektród. Az elektródpotenciál ebben az esetben:
![]() (31)
(31)
ahol K a rosszul oldódó
só oldhatósági szorzata (az adott esetben K=[Ag+]·[Cl-]).
Vegyük észre, hogy az elektródpotenciál ebben
az esetben nem a kation, hanem az anionkoncentráció függvénye.
Az ilyen másodfajú elektródokat széleskörûen alkalmazzák az elektrokémiai méréstechnikában, mint (másodlagos) potenciál-referenciákat; a két másodfajú elektródból álló un. normálelemek feszültségetalonként használatosak.
A koncentrációs elemek olyan galvánelemek, amelyekben a két félcella redoxrendszere azonos, de a két félcella között koncentrációkülönbség van. Például ilyen a Cu | c1 mol/dm3 CuSO4 || c2 mol/dm3 M CuSO4 | Cu elem, melynek elektromotoros ereje a koncentrációk és aktivitások közötti különbség elhanyagolása miatt közelítôleg
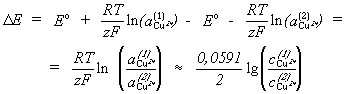 (32)
(32)
Konkrét koncentrációk
behelyettesítésével meggyôzôdhetünk
arról, hogy a koncentrációs elemek elektromotoros
ereje viszonylag kicsi; a fenti cellánál, például,
10-szeres koncentráció arány esetén D
E@
0,03 V.