Kémiai megközelítések a funkcionális állapot jellemzésére
Általános kémiai szemléletünk egyik eleme az a feltételezés, hogy egymással korlátlanul elegyedő folyadékok homogén fázist képeznek, melyben a koncentráció bármely legkisebb térrészben azonos. Egy néhány napja megjelent dolgozat szerint ez nincs így; metanol és víz 7 : 3 arányú elegyében neutrondiffrakciós vizsgálat szerint a vízmolekulák többsége hidrogénkötéssel összefűzött fonalakat képez a metanol molekulák klaszterei között.1 A metanol- és vízmolekulák elkülönülése arra utal, hogy az intermolekuláris kölcsönhatásokat nem eléggé ismerjük. Nehéz megértenünk, hogy miért nem a víz-metanol hidrogénkötések dominálnak az elegyben, ami biztosíthatná a molekulák homogén eloszlását. A szekunder kötőerők ismerete azért is fontos, mert ezek határozzák meg a fehérjék konformációját, a konformáció megváltozását, a fehérje felületén létrjövő adszorptív kötődéseket, és a különböző kompartmentek közötti transzport folyamatát. E jelenségek mindegyike alapvető szerepet játszik biológiai folyamatokban.
Az idegsejtek membránjába ágyazott, ligandkötődés által szabályozott ioncsatornát öt receptor-alegység hozza létre. A csatorna belső falát hidrofil oldalláncot tartalmazó aminosavak határolják. Neurotranszmitter, vagy agonista hatású molekula kötődésére az ioncsatorna kinyílik és ionáramot enged át a membránon. Ilyenkor az ionok hidrátburka a csatorna belsejében lévő hidrofil csoportokra cserélődik. Antagonista hatású molekula kötődésére a csatorna bezárul; az alegységek elfordulnak és az ion számára át nem járható szűkületet hoznak létre. A kötődés termodinamikája jellemző a kötődő molekula hatására. Az antagonista kötődés exoterm; bár az asszociáció molszám-csökkenéssel jár, a hidrofób felületek adszorpciója határozza meg a folyamat irányát. Ezzel ellentétben az agonisták kötődésének hajtóereje az entrópia növekedése a csatornanyitással kapcsolatos konformációváltozás és a dehidratációval járó molszám-növekedés következtében. A jelenség molekuláris biológiai úton létrehozott humán, és patkányból származó természetes GABAA receptorokra egyaránt érvényes,2 sőt kiterjed a glicin receptorokra, valamint igen széles tartományban a szerotonin 5-HT3 receptorokra is.3
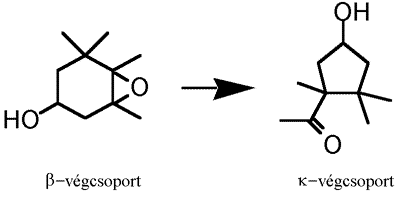
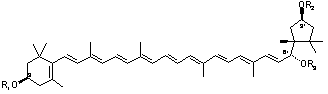
A Pécsi Egyetemen folyó nagy hagyományú karotinoid kutatás egyik új eredménye annak kimutatása, hogy a hattagú gyűrűs b-végcsoporton létrejövő 5,6-epoxidok öttagú k-végcsoporttá való átalakítását végző enzímek csak a pirosra érő paprikában vannak jelen.4 Ezért az 1927-ben Zechmeister és Cholnoky által izolált kapszantin,5 és a kapszorubin csak a piros paprikában képződnek. Az 5,6-epoxidok átalakulásának fontos jellemzője a poliénlánccal konjugált karbonilcsoport képződése, ami a szín elmélyülését okozza. A karbonil redukciójával félszintetikus kapszantol epimerek keletkeznek, amelyek kromatográfiás úton választhatók szét6. A sztereoizomerek alkoholos oldatának CD spektruma meglehetősen jellegtelen, ami arra utal, hogy a kromofór királis perturbációja gyenge.

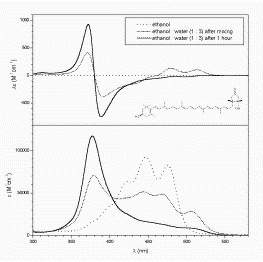
Jelentős változás áll be a CD spektrumban az alkoholos oldat vízes hígítására; a molekuláris kiralitásét többszázszorosan meghaladó intenzitású exciton sávpár jelenik meg, ami a karotinoid molekulák víz hatására bekövetkező önasszociációjának (self-assembly) következménye.7 A molekulák királis rendezettségéből származó szupramolekuláris kiralitás8 kétféle csoportba sorolható a szomszédos molekulák illeszkedése szerint. A szoros illeszkedésű aggregátumban az egyes molekulák közvetlen szomszédaikkal hegyesszöget zárnak be, a fényelnyelés szűk energiasávban történik és az exciton sávpár síma lefutású. Laza illeszkedésű aggregátumban az egymással párhuzamos szomszédos molekulák kiterjedt réteget képeznek amelyen belül viszonylag szabadon mozoghatnak. Az egymás fölött elhelyezkedő rétegek azonban elcsavarodnak és királis indukciót okoznak. A CD spektrumban az exciton sávpár széles és vibronikus tagolást mutat; a molekulák C=C kettőskötéseinek vibrációs átmenete rárakódik az elektrongerjesztésre.9 Mindkét asszociátumban a szomszédos molekulák átlapolási szöge negatív, amit az exciton sávpár magasabb hullámhosszú sávjának előjele mutat.
 |
 |
| Szoros illeszkedésű 6’R-kapszantolon
asszociátum
CD és UV spektruma |
Laza illeszkedésű 6’S-kapszantolon
asszociátum
CD és UV spektruma |
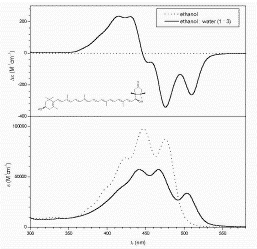
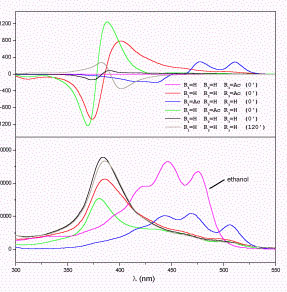
A molekuláris és szupramolekuláris kiralitás kapcsolatának felderítése céljából elkészítettük a 6’R-kapszantol 7 lehetséges acetátját,10 és összefüggést kerestünk a karotinoid molekulák szerkezete és a belőlük képződő szupramolekulák CD spektruma között. Megállapítottuk, hogy szoros illeszkedésű aggregátum akkor jön létre, ha a karotinoid molekula mindkét végén legalább egy szabad hidroxilcsoport található.11 Minden más esetben laza szerkezetű szupramolekulát kapunk.11
 |
 |
| 6’R-kapszantol és
mono-acetátjainak
CD és UV spektruma |
6’R-kapszantol,
valamint di- és tri-acetátjainak
CD és UV spektruma |
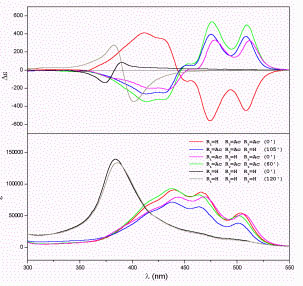
Az indukált (intermolekuláris) kiralitás intenzív spektrumát fehérjemolekulák kötőhelyeinek szondázására kívántuk felhasználni. A fehérjekötőhely geometriája egyfelől meghatározza a megkötődő ligand konformációs torzulását12 másrészt jellemző a fehérjemolekula funkcionális állapotára. A gyűrűs végcsoport nélküli akirális karotinoid dikarbonsav, krocetin a szérum albumin zsírsavkötőhelyeit foglalja el és a kötődés exciton jellegű CD spektrumot indukál.13 Ez a jelenség egymás közelében kötődő ligandmolekulák elektron kölcsönhatásától származik. Ebben a vonatkozásban jellemző különbség van a humán és sertés szérum albumin között: míg a humán fehérjén a kötött krocetin molekulák átfedése negatív szöget zár be (balkezes illeszkedés), a sertés albuminon az átfedési szög pozitív. 14
 |
 |
| Krocetin indukált spektrumai
humán szérum albuminon |
Krocetin indukált spektrumai
sertés szérum albuminon |
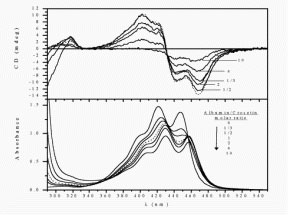
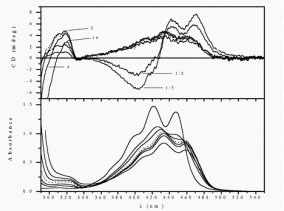
A lipokalin családba tartozó b-laktoglobulin (BLG, a tehén tejsavó fő protein-komponense) a konjugált tetraén elemet tartalmazó monokarbonsavval, cis-parinársavval jelölhető. Az 1:1 sztöchiometriájú kötődés azért indukál CD spektrumot, mert a tetraénlánc konformációs torzulása a molekulát királissá teszi. A konjugált lánc ugyanis kétféle irányban csavarodhat ki a síkszerkezetből. A CD spektrum szerint a kötődés következtében a ligandmolekula balra csavarodó torzulást szenved.
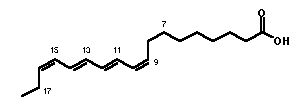
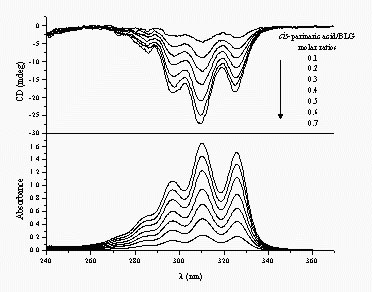
cis-Parinársav indukált kiralitása b-laktoglobulin fehérjén történő kötődés következtében
Az emberi vér gyógyszerkötődés szempontjából fontos fehérje-komponense az albuminnál 40-szer kisebb fiziológiás koncentrációjú a-savas glikoprotein (AGP). A kereskedelmi (Sigma) AGP kát fő genetikai variáns (A és F1S) 1:2 arányú keveréke, amelyeket kromatográfiás úton szétválasztottunk. Kidolgoztunk egy CD spektroszkópiás módszert a két variáns jellemzésére. Az A variáns szelektíven jelölhető Acridine orange kötődésével, ami exciton jellegű spektrumot ad igazolva két egyidejüleg kötött festékmolekula kölcsönhatását. A CD spektrum nem változik dipyridamol (F1S-referencia ligand) hatására, de intenzitása erősen csökken az A variánson szelektíven kötődő disopyramide jelenlétében.
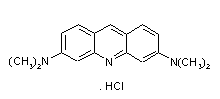
AO
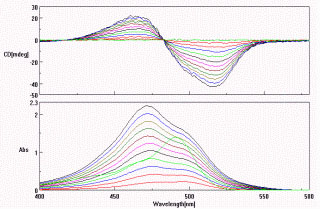
Acridin orange (AO) kötődése az AGP A genetikai variánsán exciton jellegű CD spektrumot indukál
Az F1S variáns szelektíven jelölhető dicumarol
(dic) kötődésével. Az akirális ligandmolekula a fehérje kötőhelyén a kumaringyűrűket
összekötő egyes kötések körüli elfordulás következtében királissá válik
és CD spektrumot hoz létre. A jelenség megváltozik egyidejűleg kötődő deramciclane
(DC) jelenlétében amikor a CD spektrum a konformáció inverzióját jelzi.
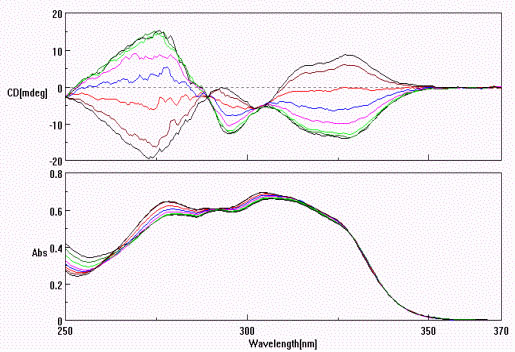
A dic indukált kiralitása inverziót szenved az AGP F1S variánsán egyidejűleg kötődő DC jelenlétében
Az AGP különböző súlyos betegségek markereként használatos a klinikai gyakorlatban. A genetikai variánsok szelektív mérése hozzájárul a funkcionális állapot, ill. az attól való eltérés érzékeny jellemzéséhez.
A fenti eredmények kidolgozására az NKFP 1/047/2001
(MediChem) pályázat támogatásával került sor.
Bibliográfia
1. Dixit S, Crain J, Poon WCK, Finney JL, Soper AK: Molecular segregation observed in a concentrated alcohol-water solution. Nature April 25 2002, 416, 829-832.
2. Maksay G, McKernan R: Entropy as the predominant driving force of binding to human recombinant axb3g2) GABAA receptors. Eur J Pharmacol 2001, 411, 55-60.
3. Maksay G: Thermodynamics of ionotropic GABAA, glycine and 5-HT3 type serotonin receptor interactions. In Drug-Receptor Thermodynamics: Introduction and Applications, ed Raffa RB, Wiley, Chicester, 2001, pp 359-376.
4. Deli J, Molnár P, Matus Z, Tóth G: Carotenoid composition in the fruits of red paprika (Capsicum annuum var. lycopersiciforme rubrum) during ripening. J Agric Food Chem, 2001, 49, 1517-1523.
5. Zechmeister L, Cholnoky L: Vizsgálatok a paprika festékéről. MTA Matematikai és Természettudományi Értesítője, 1927, 44, 404-419.
6. Deli J, Ősz E, Visy J, Zsila F, Simonyi M, Toth G: Stereoselective reduction of 'capsanthol-3 '-ones' (=3,6 '-dihydroxy-beta,kappa-caroten-3 '-ones) by complex hydrides. Helv Chim Acta, 2001, 84, 263-270.
7. Zsila F, Bikadi Z, Deli J, Simonyi M: Configuration of a single centre determines chirality of supramolecular carotenoid self-assembly. Tetrahedron Lett, 2001, 42, 2561-2563.
8. Zsila F, Deli J, Bikadi Z, Simonyi M: Supramolecular Assemblies of Carotenoids. Chirality, 2001, 13, 739-744.
9. Zsila F, Bikadi Z, Deli J. Simonyi M: Chiral detection of carotenoid assemblies. Chirality, 2001, 13, 446-453.
10. Molnár P, Ősz E, Zsila F, Simonyi M, Tóth G, Deli J: Helv Chim Acta, 2002, in press.
11. Bikadi Z; Zsila F; Deli J; Mady G; Simonyi M: The supramolecular structure of self-assembly formed by capsanthin derivatives. Enantiomer, 2002, 7, 67-76.
12. Simonyi M: The Concept of Chiral Conformers and its Significance in Molecular Pharmacology. In Advances in Drug Research, Academic Press, 1997, 30, 73-110.
13. Zsila F; Bikadi Z; Simonyi M: Induced chirality upon crocetin binding to human serum albumin: origin and nature. Tetrahedron Asym, 2001, 12, 3125-3137.
14. Zsila F; Bikadi Z; Simonyi M: Further insight into the molecular basis of carotenoid-albumin interactions: circular dichroism and electronic absorption study on different crocetin-albumin complexes. Tetrahedron Asym, 2002, 13, 273-283.
15. Zsila F; Imre T; Szabó PT; Bikadi Z; Simonyi
M: Induced chirality upon binding of cis-parinaric acid to bovine
beta-lactoglobulin: spectroscopic characterization of the complex. FEBS
Lett, 2002, 520, 81-87.
| Gyógyszerkutatás: jelen és jövő | http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |