Y = O, CHCH2CH=CH2, C(CH2CH=CH2)2
R = Me, i-Bu, t-Bu
1. ábra
Samu Erika
Új piridin, akridin és fenazin egységet tartalmazó koronaéterek elõállítása molekuláris felismerés tanulmányozása céljából
Budapesti Mûszaki és Gazdaságtudományi Egyetem
2000
Doktori munkám célja primer szerves ammóniumsó enantiomerekkel szemben egyre jobb enantioszelektív komplexképzést mutató, enantiomertiszta királis koronaéterek elõállítása volt. Munkám során tizenhét új piridin, akridin, illetve fenazin heteroaromás egységet tartalmazó királis koronaétert és két akirális ligandumot állítottam elõ.
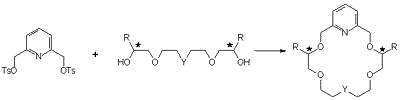
A piridin heteroaromás egységet tartalmazó ligandumokat
az aszimmetriacentrumokon megfelelõen szubsztituált tetraetilénglikolok
{Y = O; R = Me, i-Bu,
t-Bu}, illetve a terminális
kettõskötésû oldallánco(ka)t tartalmazó
királis diolok {Y = CHCH2CH=CH2, C(CH2CH=CH2)2;
R = Me, i-Bu,
t-Bu} és a 2,6-piridindimetanol ditozilát
erõs bázis jelenlétében végzett éterképzési
reakciójában állítottuk elõ (1. ábra).

Y = O, CHCH2CH=CH2, C(CH2CH=CH2)2
R = Me, i-Bu, t-Bu
1. ábra
Az akirális koronaétereket az akridin-4,5-diol {Z = CH; W = OH}, illetve a fenazin-1,9-diol {Z = N; W = OH} és a tetraetilénglikol ditozilát {Q = OTs; Y = O; R = H} reakciójában állítottuk elõ (2. ábra).
Szintézismódszert dolgoztunk ki az enantiomertiszta királis akridin, illetve fenazin egységet tartalmazó koronaéterek elõállítására az akridin-4,5-diol, illetve a fenazin-1,9-diol és a királis tetraetilénglikol ditozilátok {Q = OTs; Y = O; R = Me, i-Bu, s-Bu}, illetve a királis diol ditozilátok {Q = OTs; Y = CHCH2CH=CH2, C(CH2CH=CH2)2; R = Me, i-Bu} felhasználásával (2. ábra).
Modellkísérleteket végeztünk a reakció körülményeinek pontos meghatározására, valamint a teljes inverzió biztosítása céljából.
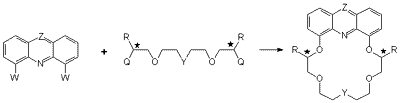
Z = N, CH; W = OH, Cl; Q = OTs, OH
Y = O, CHCH2CH=CH2, C(CH2CH=CH2)2
R = H, Me, i-Bu, s-Bu
2. ábra
Egy újabb szintézismódszert bevezetve az 1,9-diklórfenazint {Z = N; W = Cl} reagáltattuk az aszimmetriacentrumokon metilcsoporttal szubsztituált tetraetilénglikollal {Q = OH; Y = O; R = Me}, illetve a terminális kettõskötésû oldallánco(ka)t tartalmazó királis diolokkal {Q = OH; Y = CHCH2CH=CH2, C(CH2CH=CH2)2; R = i-Bu} (2. ábra).
Két királis ligandum esetében {Z = N; Y = O, CHCH2CH=CH2; R = Me, i-Bu} igazoltuk, hogy a fenazin-1,9-diol és a megfelelõ királis diol ditozilátok ciklizációja teljes inverzióval jár. Az 1,9-diklórfenazin ciklizációs reakciójával egy olyan ligandumot {Z = N; Y = C(CH2CH=CH2)2; R = i-Bu} is elõállítottunk, amit a fenazin-1,9-diolból kiindulva nem sikerült.
A királis prekurzorokat többlépéses szintézissel állítottuk elõ, egyszerû, olcsó, könnyen hozzáférhetõ királis alapanyagokból kiindulva, az enantiomertisztaság megõrzésével.
A terminális kettõskötésû oldallánco(ka)t tartalmazó királis diolok elõállítására {Q = OH; Y = CHCH2CH=CH2, C(CH2CH=CH2)2; R = Me, i-Bu, t-Bu} hatlépéses szintézist dolgoztunk ki.
Dietil-allilmalonátból, illetve dietil-diallilmalonátból kiindulva állítottuk elõ a 3-as helyzetben terminális kettõskötésû oldallánco(ka)t {Y = CHCH2CH=CH2, C(CH2CH=CH2)2} tartalmazó pentán-1,5-diolokat, majd azokat a szekunder hidroxilcsoportján védett királis etilénglikol monotozilátokkal {R = Me, i-Bu, t-Bu} erõsen bázikus körülmények között reagáltatva és a védõcsoportokat eltávolítva jutottunk az 1. és a 2. ábrán látható királis diolokhoz.
Az utóbbi diolokból állítottuk elõ a királis diol ditozilátokat {Q = OTs; Y = CHCH2CH=CH2, C(CH2CH=CH2)2; R = Me, i-Bu}; a tetraetilénglikolok-ból pedig a tetraetilénglikol ditozilátokat {Q = OTs; Y = O; R = H, Me, i-Bu, s-Bu}.
A prekurzorokhoz vezetõ szintézis során közel negyven új vegyületet - többségükben enantiomertiszta királis molekulákat - szintetizáltunk és jellemeztünk.
Ezek az enantiomertiszta vegyületek számos egyéb királis molekula kiindulási anyagul is szolgálhatnak.
A heteroaromás egységek bevitelére szolgáló akridin-4,5-diolt {Z = CH; W = OH}, illetve fenazin-1,9-diolt {Z = N; W = OH} a szakirodalomban közölt eljárás módosításával egyszerûbb, méretnövelhetõ, jobb termeléssel járó, tisztább terméket eredményezõ módszerrel állítottuk elõ.
Az aszimmetriacentrumokon metilcsoportot, a makrogyûrûben csak éteroxigént tartalmazó fenazin-18-korona-6 ligandum {Z = N; Y = O; R = Me} esetében a koronaéterbõl, és mindkét NEA enantiomerrel képzett diasztereomer komplexébõl röntgendiffrakciós vizsgálatokra alkalmas kristályokat készítettünk.
Az általam szintetizált, értekezésemben ismertetett új királis ligandumok szerves ammóniumsó enantiomerekkel szemben mutatott enantioszelektív komplexképzését több független módszerrel (titrálásos 1H NMR spektrószkópia, cirkuláris dikroizmus spektroszkópia, lumineszcencia spektroszkópia, röntgendiffrakció, molekulamechanikai számítások) vizsgáltuk.
Ezúton szeretném megköszönni témavezetõm, Dr. Huszthy Péter áldozatkész segítségét, aki kezdeményezte, irányította és végigkísérte munkámat.
Synthesis of novel piridino-, acridino- and phenazino-crown ethers for molecular recognition studies
Ph.D. thesis,
Budapest University of Technology and Economics
2000
The objective of my Ph. D. work was to prepare enantiomerically pure chiral crown ethers showing enhanced enantioselective complexation with the enantiomers of chiral primary organic ammonium salts. During my work I synthetized two new achiral and seventeeen novel chiral crown ethers containing pyridine, acridine and phenazine heterocyclic units.
The ligands with pyridine unit were prepared from tetraethylene glycols
containing suitable substituents at the stereogenic centers and diols with
the same groups at the stereogenic centers , but the latters were also
containing sidechains with terminal double bonds, respectively and from
2,6-pyridinedimethanol ditosylate in strong basic conditions to perform
the cyclization by formation of ether bonds.(Fig. 1.)

Y = O, CHCH2CH=CH2, C(CH2CH=CH2)2
R = Me, i-Bu, t-Bu
Fig. 1.
The achiral crown ethers were prepared from acridine-4,5-diol and phenazine-1,9-diol, respectively using teraethylene glycol ditosylate. We elaborated a synthetic method for the preparation of enantiomerically pure chiral acridino- and phenazino-crown ethers starting from acridine-4,5-diol and phenazine-1,9-diol, respectively and from chiral tetraethylene glycol ditosylates and chiral diol ditosylates, respectively. (Fig. 2.) We carried out model experiments to determine the exact reaction conditions and also to secure the total inversion of configuration of the stereogenic centers.

Z = N, CH; W = OH, Cl; Q = OTs, OH
Y = O, CHCH2CH=CH2, C(CH2CH=CH2)2
R = H, Me, i-Bu, s-Bu
Fig. 2.
We also elaborated another new method in which 1,9-dichlorophenazine was reacted with the enantiomerically pure dimethyl-substituted tetraethylene glycol and enantiomerically pure diisobutyl-substituted diols containing sidechains with terminal double bond, respectively.
In cases of two chiral ligands we proved by the results of the latter reaction that the former cyclization which involves the stereogenic centers accompanied by total inversion of configuration. By the cyclization method starting from 1,9-dichlorophenazine we were able to prepare a ligand which one could not be obtained by the other cyclization method starting from phenazine-1,9-diol.
The chiral precursors were prepared by multistep syntheses starting from easily available, simple and cheap chiral starting materials with conservation of optical purity. We elaborated a six-step sythesis for the preparation of chiral diols containing sidechains with terminal double bond starting from diethyl allylmalonate and diethyl diallylmalonate, respectively. First pentane-1,5-diols containing sidechains with terminal double bond at position 3 were prepared from the above mentioned two esters, then these diols were reacted with primary chiral ethylene glycol tosylates protected at the secondary hydroxyl group and eventually the protecting group was removed to give chiral diols which served as the immediate precursors for the preparation of chiral ligands. Tetraethylene glycol ditosylates and diol ditosylates, respectively were prepared from the appropriate tetraethylene glycols and diols, respectively.
In course of the syntheses leading to the precursors nearly 40 new compounds
- mainly enantiomerically pure chiral ones - were prepared and characterized.
These enantiomerically pure compounds can also be the building blocks of
other important chiral molecules. With modifying the reported syntheses
of acridine-4,5-diol and phenazine-1,9-diol we obtained a simpler, higher-yield
and purer-product giving method which can also be applicable in larger
scale for the preparation of these precursors which serve building-in the
heterocyclic units of the crown ethers containing acridine and phenazine
subcyclic units. We prepared suitable crystals for X-ray studies from enantiomerically
pure chiral dimethyl-phenazino-18-crown-6 ligand and also from its complexes
with both enantiomers of a -(1-naphthyl)ethyl ammonium perchlorate. The
enantioselective complexation of novel chiral crown ethers described in
my Ph.D. thesis with the enantiomers of chiral organic ammonium salts were
studied with several independent methods such as 1H NMR spectroscopy,
circular dichroism spectroscopy, luminescence spectroscopy, X-ray diffraction
and molecular mechanical calculations.
Publications
1. Erika Samu, Péter Huszthy, György Horváth,
Áron Szöllõsy, András Neszmélyi: Enantiomerically
pure chiral pyridino-crown ethers: synthesis and enantioselectivity toward
the enantiomers of a -(1-naphthyl)ethylammonium perchlorate
Tetrahedron: Asymmetry, 1999, 10, 3615-3626.
2. Erika Samu, Péter Huszthy, László Somogyi,
Miklós Hollósi: Enatiomerically pure chiral phenazino-crown
ethers: synthesis, preliminary circular dichroism spectroscopic studies
and complexes with the enantiomers of 1-arethyl ammonium salts
Tetrahedron: Asymmetry, 1999, 10, 2775-2795
3. Péter Huszthy, Erika Samu, Borbála Vermes,
Gabriella Mezey-Vándor, Mihály Nógrádi, Jerald
S. Bradshaw, Reed M. Izatt: Synthesis of novel acridino- and phenazino-18-crown-6
ligands and their optically pure dimethyl-substituted analogues for molecular
recognition studies
Tetrahedron, 1999, 55, 1491-1504
4. Tímea Gérczei, Zsolt Böcskei, György Miklós
Keserû, Erika Samu, Péter Huszthy: Enatiomeric recognition
of a -(1-naphthyl)ethylammonium perchlorate by enantiomerically pure dimethylphenazino-18-crown-6
ligand in solid and gas phases
Tetrahedron: Asymmetry, 1999, 10, 1995-2005
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |