1. ábra
2. ábra
Frank Éva
Ösztránvázas D-szekoszteroidok gyûrûzárási reakciói
Doktori (PhD) értekezés összefoglalása
Szegedi Tudományegyetem
Természettudományi Kar
Szerves Kémiai Tanszék
Szeged
2000
I. Bevezetés és célkitûzések
A Szegedi Tudományegyetem Szerves Kémiai Tanszékének szteroid munkacsoportjában korábban külön-bözõ D-szekoszteroidok elõállítására került sor. Az így kapott vegyületekben lévõ formil- és propenil-csoport egyidejû jelenléte alkalmas synthonná tette a molekulát a különféle heteroatomot tartalmazó származékok elõállítására.
Munkánk során az ösztron-3-metil-, illetve 3-benziléterbõl
készült fragmentum gyûrûzárási reakcióit
tanulmányoztuk. Az átalakításokat kettõs
céllal végeztük. Lehetõség nyílt
egyrészt a különbözõ ciklizálási
reakciók mechanizmusának értelmezésére,
másrészt farmakológiailag ígéretes vegyületek
szintézisére került sor.
II. A tudományos eredmények összefoglalása
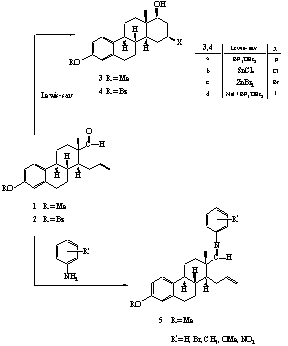
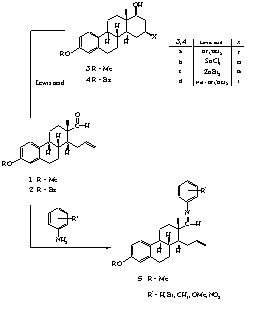
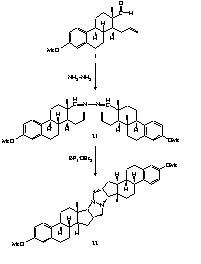
II.1. A 3-metil- és a 3-benziléter-fragmentumból (1, 2) kiindulva Lewis-savak jelenlétében intramolekuláris reakcióval D-homoszteroidokhoz (3, 4) jutottunk (1. ábra).
II.2. Megállapítottuk, hogy a D-homoszteroid képzõdése intramolekuláris Prins-reakcióval értelmezhetõ, amely során az alkalmazott Lewis-savaktól függõen F, Cl, Br, illetve I atom épül be a D-gyûrû 16-os helyén.
II.3. Spektroszkópiai módszerekkel igazoltuk, hogy a ciklizálási reakció nagyfokú sztereoszelektivitással játszódik le, a beépülõ halogénatom minden esetben ekvatoriális, b-helyzetû.
II.4. Azt tapasztaltuk, hogy a fragmentum anilinnel és annak szubsztituált származékaival Schiff-bázis képzési reakcióban vesz részt. Az így keletkezõ aza-dién rendszer (5) Lewis-savakkal gyûrûzárási reakciót mutat. Annak bizonyítására, hogy az aza-dién és a propenil oldallánc intramolekuláris Diels-Alder reakcióban, vagy többlépéses ionreakcióban vesz-e részt, a szubsztituált anilinszármazékokkal végzett átalakítások adtak választ.
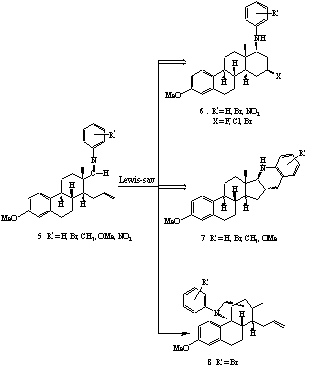
II.5. Bizonyítottuk, hogy a dezaktiváló szubsztituenseket (Br, NO2) tartalmazó ariliminek fõleg, vagy kizárólag 16b-halogén, 17ab-arilamino-D-homoszteroidokhoz (6) vezetnek. A gyûrûzárási reakció regio- és sztereoszelektíven játszódik le, és intramolekuláris Prins reakcióval értelmezhetõ (2. ábra).
II.6. Az aktiváló szubsztituenseket (CH3, OMe) tartalmazó ariliminek ezzel szemben intramolekuláris elektrofil szubsztitúcióval értelmezhetõ kondenzált heterociklusokhoz (7) vezetnek.
II.7. A reakciók némelyikében egy áthidalt szerkezetû termék (8) csekély mértékû képzõdését is megfigyeltük.

1. ábra

2. ábra
II.8. Kimutattuk, hogy legtöbb esetben a ciklizálási reakció két, egymással kompetitív úton játszódik le. Az egyik termékhez vezetõ intramolekuláris aza-Prins-reakció, illetve a másik terméket eredményezõ intramolekuláris elektrofil szubsztitúció relatív sebessége határozza meg a reakció fõ irányát.
II.9. Az ariliminekkel végzett gyûrûzárási reakció mindkét folyamata szekunder amint tartalmazó szteroidok elõállítására adott lehetõséget. Ezek szerkezetét, sztereokémiai viszonyait NMR-spektroszkópiai módszerekkel, illetve röntgen-szerkezetvizsgálattal bizonyítottuk.
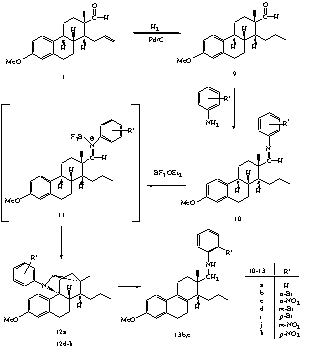
II.10. A kiindulási fragmentum propenil oldalláncának telítésével kapott terméket (9) ariliminképzési reakcióba vittük. Azt találtuk, hogy ennek BF3.OEt2-tal végzett reakciója ugyancsak ciklusos termékhez (12) vezet (3. ábra). Spektroszkópiai úton igazoltuk, hogy a keletkezett vegyület egy sajátos, áthidalt szerkezetû tercier amint hordozó szteroid alkaloid.
II.11. Bizonyítottuk, hogy az áthidalt szerkezetû termék az ariliminbõl Lewis-savval kialakuló imíniumion (11) hatására képzõdik. Az imíniumion által kiváltott 1,5-hidridion vándorlással, majd az ezt követõ intramolekuláris reakcióval értelmezhetõ a vegyület keletkezése.
II.12. Kimutattuk, hogy az áthidalt szerkezetû vegyület a meta- és para-helyzetben elektronvonzó szubsztituensek (Br, NO2) esetében játszódik le jó nyeredékkel.
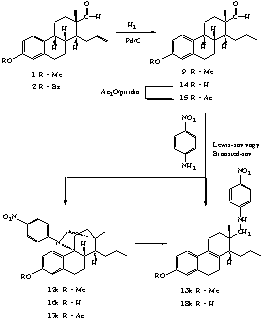
II.13. Azt találtuk, hogy az orto-helyzetû szubsztituensek esetében - feltehetõen sztérikus okok miatt - a ciklizált termék helyett a szteránváz B-gyûrûjében telítetlen szekunder aminok (13) képzõdnek.
II.14. Az iminképzéshez p-nitro-anilint felhasználva vizsgáltuk különbözõ Lewis-savak (BF3.OEt2, SnCl4, Me2SnCl2, AlCl3, TiCl4, CF3SO2OSiMe3) és BrA nsted-savak (p-TsOH, HBF4.OEt2) hatását a ciklizációra (4. ábra). Megfigyeléseink szerint az áthidalt termék (12k) képzõdésének a Lewis-savak közül leginkább a BF3.OEt2 kedvezett, míg Bronsted-savak alakalmazása esetén fõként az eliminációs termék (13k) keletkezését tapasztaltuk.
3. ábra
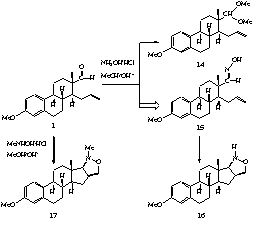
II.15. A savak hatásán kívül tanulmányoztuk a szteránváz 3-as helyzetû szubsztituensének a reakció irányára gyakorolt hatását. Kimutattuk, hogy a 3-acetoxi fragmentum (15) esetében csak az áthidalt származék (17k) képzõdik csekély hozammal, míg a 3-hidroxi vegyületnél mind az áthidalt (16k), mind az eliminációs terméket (18k) izoláltuk. A szteroid-acetát kis reakcióképessége azzal magyarázható, hogy a köztitermékként keletkezõ kation képzõdése nem kedvezõ, míg az ösztron-fragmentum esetén ez a hatás fordított.
4. ábra
II.16. Az ösztron fragmentumot szerkezeti elemei miatt alkalmasnak találtuk 1,3-dipoláris cikloaddíciók végrehajtására, melyekkel további heterociklusos származékok sztereoszelektív szintézisét valósítottuk meg.
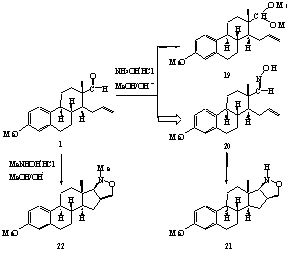
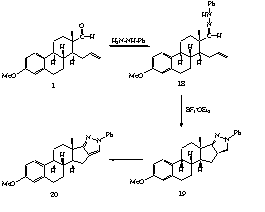
II.17. A telítetlen aldehidet (1) lúgos metanolban hidroxilamin-hidrokloriddal reagáltatva kis mennyiségben izolált acetál (19) mellett a megfelelõ szteroid aldoximot (20) kaptuk (5. ábra). A tisztított oximot katalitikus mennyiségû BF3.OEt2-tal forralva az 1,3-dipoláris cikloaddíciónak megfelelõ izoxazolidin származékhoz (21) jutottunk.
II.18. Azt tapasztaltuk, hogy a fragmentum N-metil-hidroxilamin-hidrokloriddal
egy lépésben az elõbbi izoxazolidin N-metil származékát
(22) eredményezi.
5. ábra
II.19. Szerkezetvizsgálati módszerekkel igazoltuk, hogy a heteroatomos gyûrû kapcsolódása a szteránvázhoz a C-18-as b-metilcsoporttal azonos térfélrõl történik, mindkét esetben a cisz termék keletkezik.
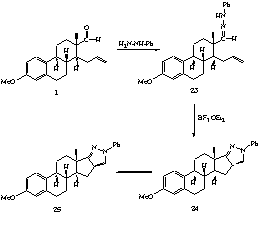
II.20. A fragmentum fenil-hidrazinnal a megfelelõ fenil-hidrazont
(23) szolgáltatja, amely BF3.OEt2
hatására kétféle terméket eredményez.
Megfigyelésünk szerint a termékarány érdekes
hõmérsékletfüggést mutat. Kloroformban,
jéghûtés mellett egy pirazolin- (24), toluolban
forralva pedig egy aromás jellege folytán stabilisabb pirazol-származék
(25) keletkezését tapasztaltuk (6. ábra).
6. ábra
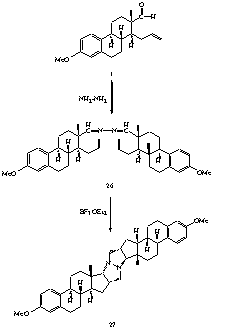
II.21. Megfigyeltük, hogy a D-szekoszteroid (1) 0.5 ekvivalens hidrazin-hidráttal a megfelelõ szteroid-aldazint (26) eredményezi, melynek BF3.OEt2 jelenlétében történõ gyûrûzárásával egy biciklusos pirazolidin származékot (27) állítottunk elõ (7. ábra).
II.22. NMR-spektroszkópiai módszerekkel bizonyítottuk,
hogy a keletkezõ bisz-szteroid (27) szimmetrikus molekula,
itt azonban a korábban említett izoxazolidin származékokkal
(21, 22) ellentétben a pirazolidin gyûrû
a szteránvázhoz a 13b-metilcsoporttal
ellentétes térfélrõl, 16a, 17a -helyzetben
kapcsolódik.
7. ábra
Köszönetem fejezem ki Dr. Schneider Gyula egyetemi tanárnak
segítõkész szakmai irányításáért
és a munkám során felmerülõ elméleti
és gyakorlati problémák megoldásában
nyújtott segítségéért. Köszönöm,
hogy beavatott a preparatív szerves kémiával és
laboratóriumi munkával kapcsolatos fontos tudnivalókba,
és megosztotta velem hasznos tapasztalatait.
Cyclization Reactions of D-Secosteroids in the Estrone Serie
PhD thesis
University of Szeged, Faculty of Sciences
Department of Organic Chemistry
Szeged
2000
I. Introduction
The "ene" reaction is defined as the addition of an olefin bearing an
allylic hydrogen (the ene component) to a double bond (the enophile) with
a shift of the olefinic double bond and the transfer of the allylic hydrogen
from the olefin to the enophile to give a homoallylic alcohol. The ene
reaction can be considered either to proceed by a concerted process or
to be a stepwise reaction occuring via an intermediate zwitterion.
When catalyzed by Lewis acids the ionic pathway seems to be preferable,
though it is mainly determined by the reaction conditions. A cationic process
leading to 1,3-halohydrines often competes with the ene reaction; moreover
it can become the exclusive pathway.
II. Discussion
The four possible isomers of 16-hydroxymethyl-3-methoxyestra-1,3,5(10)-trien-17-ol can be converted into the 16-p-tolylsulfonyloxymethyl esters. The alkaline methanolysis of the two trans isomers yields a fragmented olefinic product containing a formyl group in C-13 position. Using this compound as a starting material we could carry out of different types of transformations to synthesize new steroid analogues.
II.1. The 3-methyl (1) and 3-benzyl ethers (2) of the steroid aldehyde in the presence of Lewis acids underwent cyclization to result D-homosteroids (3, 4) (Scheme 1).
II.2. These reactions which can be explained by an intramolecular Prins-type mechanism follow a high stereoselectivity and lead to compounds containing 16b-oriented halogens in the sterane skeleton.
II.3. The reaction conditions allowed only the 1,3-halohydrines to form and the expected ene products were not found.
II.4. The steroid alkaloids are of pharmacological interest. It was our goal to synthesize novel analogues using domino reactions.
Scheme 1
II.5. The formation and reaction of the imines (5) derived from the aldehyde and aniline as well as the substituted anilines provide a highly efficient access to steroid derivatives. The imines are expected to undergo a hetero Diels-Alder reaction on treatment with Lewis or BrA nsted acids via the corresponding iminium ions. However, in contrast to the normal Diels-Alder reaction, the cycloaddition of arylimines generally follows a two-step mechanism.
II.6. The reaction of the above-mentioned estrone aldehyde with anilines in the presence of Lewis acids afforded two products, namely, an N-arylamino-D-homosteroid (6) and a tetrahydoquinoline derivative (7) in varying ratio depending on the nature of the substituent at the aniline (Scheme 2). The reaction of the iminium ion with the denophile moiety of the aldehyde
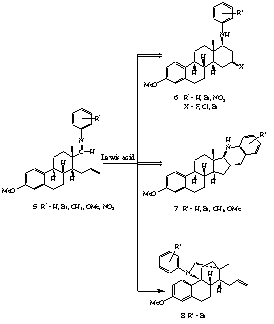
Scheme 2
intermediate results in the formation of two equilibrating carbocations. The ratio of the obtained products is determined by the rate of the addition of a nucleophile leading to a Prins-type D-homosteroid and the Friedl-Crafts alkylation yielding the tetrahydroquinoline derivative.
II.7. Electron donating groups in the aniline ring facilitated the electophilic substitution, whereas with anilines bearing electron-withdrawing substituents the Prins-type mechanism dominated. In addition, the position of the substituent should also have some influence. Only one diastereomer was found in each case.
II.8. In some of these reactions a small amount of a novel bridged steroid alkaloid (8) was also obtained.
II.9. However, a completely different pathway dominates if one hydrogenates the propenyl side chain in the steroid aldehyde (Scheme 3). The reaction of the saturated aldehyde (9) with aniline or derivatives containing an electron-withdrawing group, led to imines (10) which are rather unstable and difficult to isolate. Treatment of the crude imines with BF3.OEt2 in dichloromethane gave unusual bridged steroid alkaloids (12) in good yield as single diastereomers. The reaction sequence can also be performed more efficiently as a domino process to afford the products by preparing the imines in situ.
II.10. The transformation of the bridged compound can be explained by a 1,5-hydride shift in the corresponding iminium ion (11) to give a carbocation containing a secondary amine moiety. The addition of the amino group to the carbocationic center yields the steroid azacycle. The unsaturated product is formed in a consecutive reaction from the azacycle by elimination of the amino function.
II.11. During of these reactions an unsaturated product (13) could be isolated together with the bridged compound that can even become the main product.
II.12. To the best of our knowledge the described domino process
is a new type of transformation, though the opposite reaction, namely the
formation of an iminium ion from an amine and a carbocation, is a well-known
process.
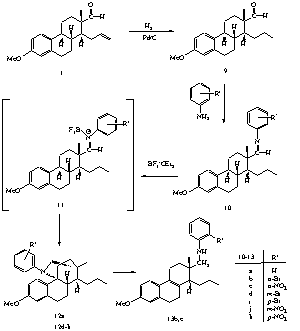
Scheme 3
II.13. These transformations are mainly influenced by the quality of the applied acid, and are also determined by the substituent at C-3 of the steroid skeleton. In the case of different Lewis (AlCl3, SnCl4, SnMe2Cl2, TiCl4) and BrA nsted acids (HBF4.OEt2, p-TsOH) the yields are much lower and the transformations are less clean compared to the reactions with BF3.OEt2.
II.14. During our experimental work intramolecular 1,3-dipolar cycloaddition was also used to prepare some more heterocyclic derivatives. The D-seco-aldehyde (1) reacted with hydroxylamine hydrochloride to give the corresponding oxime (15) (Scheme 4). The oxime could undergo cyclization in the presence of catalytic amount of BF3.OEt2 to result an isoxazolidine derivative (16).
II.15. The cyclization could also be carried out as a one-pot reaction by heating the aldehyde with N-methylhydroxylamine hydrochloride. In this case an N-methyl-isoxazolidine compound (17) is formed stereoselectively in high yield via a nitrone intermediate. The structural identification of the cis-fused isoxazolidine was accomplished by X-ray crystal analysis.
II.16. The reaction of the aldehyde (1) with phenylhydrazine in ethanol at room temperature yielded the corresponding phenylhydrazone (18) (Scheme 5). The 1,3-dipolar cycloaddition of the hydrazone resulted in a mixture of a pyrazoline (19) and a pyrazole (20) derivative. The ratio of the two products was mainly determined by the reaction conditions.
II.17. The pyrazoline could be obtained as the major product
by cyclization of the hydrazone in ice-cold chloroform. A similar reaction
in toluene under reflux gave mainly the pyrazole due to the aromatic stabilization.
The pyrazole assumed to be formed by the autooxidation of the pyrazoline
compound.
Scheme 4
II.18. The criss-cross reaction, which is a special 1,3-dipolar
cycloaddition, can be explained by two consecutive [3+2] addition steps.
The reaction of the estrone methyl ether (1) with a half equivalent
of hydrazine hydrate led to an aldazine (21) , which underwent criss-cross
reaction in the presence of BF3.OEt2
to
result in a bicyclic pyrazolidine derivative (22) (Scheme 6).
Scheme 5
Scheme 6
Publications
1. Noltemeyer, M., Tietze, L. F., Wölfling, J., Frank, É.,
Schneider, Gy. Acta Cryst. Sect. C52, 1996, 2258.
2. Bes, M., Wölfling, J., Uson, I., Pelikán, Sz., Tietze,
L. F., Frank, É., Schneider, Gy. Acta Cryst. Sect. C54, 1998,
1341.
3. Wölfling, J., Frank, É., Schneider, Gy., Tietze, L.
F. Synlett 1998, 1205.
4. Wölfling, J., Frank, É., Schneider, Gy., Tietze, L.
F. Angew. Chem. 1999, 111, 151., Angew. Chem. Int.
Ed. 1999, 38, 200.
5. Wölfling, J., Frank, É., Schneider, Gy., Tietze, L.
F. Eur. J. Org. Chem. 1999, 3013.
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.chemonet.hu/ |