Mészáros Róbert
Híg vizes alkohol oldatok adszorpciója aktív szénen
Eötvös Loránd Tudományegyetem, Budapest
1998
Az adszorbens tömege, illetve az adszorbens tömeg és az oldatfázis tömegének hányadosa – az ún. flottaarány (ms/mo) – mint vizsgálandó paraméter ritkán került az érdeklõdés középpontjába. Az ELTE Kolloidkémiai Tanszékén korábban Nagy által végzett kutatások elõször mutattak rá a híg vizes 1-propanol oldat aktív szénen történõ adszorpciójánál az adszorpciós izoterma flottaaránytól, ill. az oldatfázis kiindulási koncentrációjától való függésének lehetõségére [1-2]. Ez a jelenség a “többértékûség” elnevezést kapta a hazai adszorpciós körökben.
A “többértékûség” kérdése parázs vitát váltott ki a hazai tudományos berkekben, hiszen binér elegyek adszorpciójánál – az adszorpció kerettörvényének számító határfelületi termodinamika elvei szerint – az adszorbeált mennyiség egyértelmû függvénye az egyensúlyi koncentrációnak.
A disszertáció éppen ezért a propanol izomerek híg vizes oldatának adszorpcióját tanulmányozta aktív szeneken, célkitûzése pedig a fentiekben vázolt ellentmondás feloldása és az eredmények interpretációja volt.
Mérési eredmények és diszkusszió
Munkánk során elõször az oldatfázis
néhány rögzített kiindulási koncentrációja
mellett különbözõ flottaarányoknál
vizsgáltuk az adszorpció mértékét. A
kísérleti adatok egy hagyományostól eltérõ
reprezentációját adtuk meg, nevezetesen az oldatfázis
egyensúlyi koncentrációját a flottaarány
függvényében (![]() függvény) [3]. Ez a fajta ábrázolásmód
rendkívül hasznosnak bizonyult, hiszen segítségével
megbecsültük az egyes rögzített kiindulási
koncentrációkhoz tartozó adszorpciós izotermarészletek
konfidencia intervallumait. Ehhez egy jól illeszkedõ modellfüggvényre
és az adszorbeált mennyiség definíciójára
van szükség. Az
függvény) [3]. Ez a fajta ábrázolásmód
rendkívül hasznosnak bizonyult, hiszen segítségével
megbecsültük az egyes rögzített kiindulási
koncentrációkhoz tartozó adszorpciós izotermarészletek
konfidencia intervallumait. Ehhez egy jól illeszkedõ modellfüggvényre
és az adszorbeált mennyiség definíciójára
van szükség. Az ![]() függvények leírására kétféle
modellfüggvényt javasoltunk, melyek két differenciálegyenlet
megfelelõ peremfeltételek melletti megoldásaként
adódtak [3]:
függvények leírására kétféle
modellfüggvényt javasoltunk, melyek két differenciálegyenlet
megfelelõ peremfeltételek melletti megoldásaként
adódtak [3]:
![]()
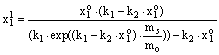
Itt ![]() és
és
![]() az oldatfázis
kezdeti ill. “egyensúlyi” koncentrációja móltörtben,
kx, k1 és k2 konstansok, ms
és mo az adszorbens illetve az oldatfázis tömege.
az oldatfázis
kezdeti ill. “egyensúlyi” koncentrációja móltörtben,
kx, k1 és k2 konstansok, ms
és mo az adszorbens illetve az oldatfázis tömege.
Az elsõ ábrán (az ábrákat ld. az angolnyelvû összefoglalóban) kísérleti egyensúlyi koncentráció–flottaarány függvényeket láthatunk öt rögzített kiindulási koncentrációnál az ezekre illesztett modellfüggvényekkel együtt. A (2) egyenletben megadott függvény kiváló illeszkedést mutatott valamennyi általunk tanulmányozott adszorpciós rendszerben. Az egyes rögzített kezdeti koncentrációkhoz tartozó adszorpciós izotermarészletek konfidencia intervallumát a (2) függvényre vonatkozó nemlineáris regresszió eredményei alapján becsültük [3-4]. A 2-es ábrán ezeket láthatjuk az 1-es ábrán feltüntetett mérési adatokat felhasználva. Jól látható, hogy az adszorbeált mennyiség nemcsak az egyensúlyi, hanem az oldatfázis kezdeti koncentrációjától is függ. Valamennyi aktív szén esetében ezt a “többértékûség”-et tapasztaltuk az 1-propanol híg vizes oldatának adszorpciója esetén. A 2-propanol/víz elegyek adszorpciójánál az észlelt effektus kisebb mértékû volt.
Ha az adszorpciós izoterma függ a rögzített kiindulási koncentrációktól, akkor nyilvánvalóan függenie kell a rögzített flottaaránytól is [4]. A 3-as ábrán az 1-propanol híg vizes oldatának elegyadszorpciós izotermája látható két rögzített flottaaránynál. Az adszorbeált mennyiségre vonatkozó konfidencia intervallumot ismételt mérések alapján becsültük.
Jól látható, hogy az egyes flottaarányokhoz tartozó adszorpciós izotermák jelentõsen eltérnek egymástól. Így a “többértékûség” szignifikanciája nem kérdõjelezhetõ meg az általunk tanulmányozott kísérleti rendszerekben.
Többértékûség – paradoxon vagy trivialitás?
A határfelületi termodinamika elvei alapján igazolható, hogy binér elegyek szilárd/oldat határfelületen történõ adszorpciója esetén az elegyadszorpciós izoterma egyértelmû függvénye a (valamelyik komponensre vonatkoztatott) egyensúlyi koncentrációnak. Ez bizonyítható homogén és heterogén, illetve sík és görbült felszínekre egyaránt. Így az elõbbiekben diszkutált mérési eredmények látszólag ellentmondásban vannak a termodinamika axiómáival. Az ellentmondás feloldása csak úgy lehetséges, ha igazoljuk, hogy a vizsgált kísérleti rendszerek esetében (az adott hõmérsékleten, t=25 oC-on) nem beszélhetünk egyensúlyi binér elegy adszorpcióról.
Megállapítottam, hogy az egyensúly beálltának kérdése kulcsfontosságú a “többértékûség” értelmezésében. Az 1-propanol/víz elegyekre vonatkozóan az adszorpció mértéke nagy mértékben függött a rendszer végsõ állapotához való eljutás módjától! Az oldatfázis két komponensének mennyiségére vonatkozó reverzibilitás hiánya és a tapasztalt “többértékûség” (az oldatfázis kezdeti összetételétõl függõ) metastabilis állapotok feltételezésével vált értelmezhetõvé. Erre utal az a kísérleti tény is, hogy magasabb hõmérsékleten (65 oC-on) az 1-propanol híg vizes oldatának adszorpciója függetlenné válik a flottaaránytól. Ezen a hõmérsékleten ugyanis a rendszer már egyensúlyi állapotba került.
A metastabilis állapot értelmezéséhez egy egyszerû modellt dolgoztam ki. Ez a felületi fázis és az adszorpciós kicserélõdési reakció koncepcióján alapszik, valamint azon a feltételezésen, hogy a felületen lévõ víz egy része metastabilis állapotban van és nem vesz részt az adszorpció dinamikájában. Igazoltam, hogy a metastabilis víz mennyiségét növelve a fajlagos redukált többletmennyiség értékei csökkennek egy adott egyensúlyi koncentrációnál. A kiindulási elegy összetételétõl függõen különbözõ mennyiségû metastabilis víz hipotézisével értelmezhetõvé vált az 1-propanol adszorpciós izotermájának függése a kiindulási ill. szorbens “koncentráció”-tól.
Adsorption from dilute aqueous solutions of alcohols onto activated carbons
Ph.D. thesis, Eötvös Loránd University,
Budapest
1998
The dependence of adsorption data of binary mixtures on the adsorbent mass or on the ratio of the adsorbent mass to the mass of the solution phase has not been investigated too often. The reason of this fact is quite obvious: the values of the intensive quantities determine unambiguously the equilibrium state of a thermodynamic system. So the dependence on the masses of the given phases possess no special importance.
According to the results made by Nagy in our laboratory , the adsorption isotherm of 1-propanol seemed to depend not only on the equilibrium concentration but on the initial concentration of the solution, too [1]. That means, that the adsorption isotherm of 1-propanol depends on the fixed values of sorbent “concentration” (defined as the ratio of the adsorbent mass to the mass of the solution), too [1-2].
In the present work the adsorption of propanol isomers from dilute aqueous solution onto activated carbons were investigated. The main aim of the dissertation was to prove the existence of the dependence of adsorption isotherms on the initial concentration and the sorbent “concentration” in the investigated adsorption systems. On the other hand, an attempt was made to interpret the observed strange effects.
Results and discussion
First the quantity of the activated carbon relatively to the mass of
the solution was varied at several fixed initial concentrations of the
solution. It was proved experimentally and theoretically, that the equilibrium
concentration (![]() )
is an unambiguous function of the sorbent “concentration” (ms/mo)
at constant initial concentration [1-3]. For description of these equilibrium
concentration - sorbent “concentration” curves the solution functions of
two kinds of differential equations at the proper boundary conditions were
proposed.
)
is an unambiguous function of the sorbent “concentration” (ms/mo)
at constant initial concentration [1-3]. For description of these equilibrium
concentration - sorbent “concentration” curves the solution functions of
two kinds of differential equations at the proper boundary conditions were
proposed.
| (1) | |
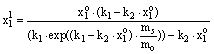 |
(2) |
Here ![]() and
and
![]() is the initial
and equilibrium mole fraction of the solution phase, kx , k1
and k2 are constants, ms and mo denote
the mass of the adsorbents and the mass of the solution, respectively.
is the initial
and equilibrium mole fraction of the solution phase, kx , k1
and k2 are constants, ms and mo denote
the mass of the adsorbents and the mass of the solution, respectively.
In Figure 1. the experimental points of the ![]() -(ms/mo)
curve are shown together with the fitted functions of eqs. (1) and (2).
-(ms/mo)
curve are shown together with the fitted functions of eqs. (1) and (2).
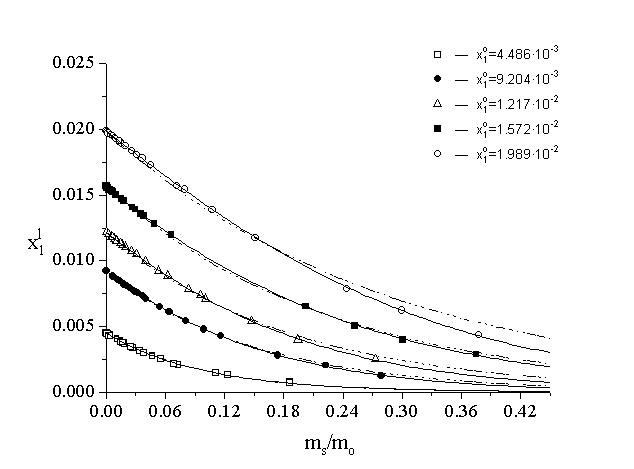
Figure 1.
The equilibrium concentration of 1-propanol as a function of sorbent “concentration” at five fixed initial concentration for the adsorption on activated carbon type Norit RO 0.8 (at 25 oC). The various symbols denote the experimental points, the dotted and continuous lines belong to the fitted functions of eqs. (1) and (2), respectively.
It turned out, that the goodness of fit was excellent for the function
of eq. (2) in each case. By making use of the results of a non-linear fitting
procedure referring to the analytical expression of the ![]() -(ms/mo)
function of eq. (2) and the definition of the specific surface excess amount,
one can give a good estimation for the smoothed adsorption isotherms and
their confidence intervals belonging to the different fixed initial concentrations
of the solution phase [3-4]. The smoothed adsorption isotherms of 1-propanol
(component 1) from dilute aqueous solution and the confidence intervals
of them at five, fixed initial concentrations were plotted (using the data
of Figure 1.) in Figure 2. As it can be seen, the parts of the adsorption
isotherm belonging to different initial concentrations are split up into
separate curves in a quite wide range of the equilibrium concentration.
This was true for all kinds of the investigated activated carbons. The
observed dependence of adsorption isotherms on the initial concentration
was proved to be smaller for the adsorption of 2-propanol/water mixtures.
-(ms/mo)
function of eq. (2) and the definition of the specific surface excess amount,
one can give a good estimation for the smoothed adsorption isotherms and
their confidence intervals belonging to the different fixed initial concentrations
of the solution phase [3-4]. The smoothed adsorption isotherms of 1-propanol
(component 1) from dilute aqueous solution and the confidence intervals
of them at five, fixed initial concentrations were plotted (using the data
of Figure 1.) in Figure 2. As it can be seen, the parts of the adsorption
isotherm belonging to different initial concentrations are split up into
separate curves in a quite wide range of the equilibrium concentration.
This was true for all kinds of the investigated activated carbons. The
observed dependence of adsorption isotherms on the initial concentration
was proved to be smaller for the adsorption of 2-propanol/water mixtures.
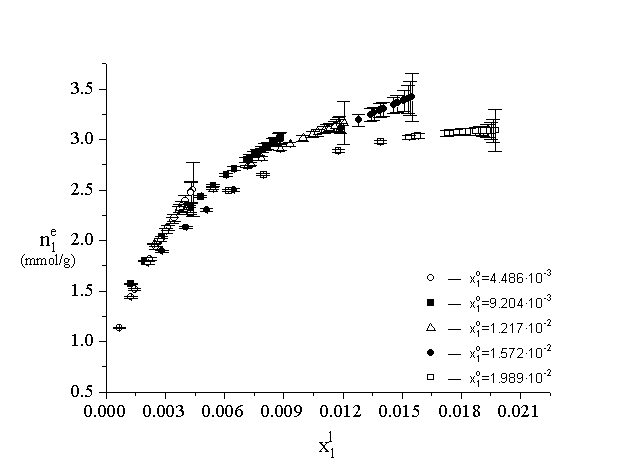
Figure 2.
The adsorption isotherm of 1-propanol from dilute aqueous solution on Norit RO 0.8 at five, fixed initial concentration (at 25 oC). The various symbols refer to the different values of the initial composition of the solution phase. The estimated values of the confidence intervals (referring to the specific surface excess at a=0.05 significance level) were plotted in the usual way.
It was necessary to test the existence of the observed strange effect by at least one alternative method. Suppose, that instead of the initial concentration the sorbent “concentration” (ratio of the adsorbent mass to the mass of the solution phase) is fixed. If the adsorption isotherm depends on the initial concentration, it must also depend on the fixed values of sorbent “concentration”.
In Figure 3. several points of the adsorption isotherm belonging to the two fixed values of sorbent “concentration” were plotted for the adsorption of 1-propanol on Norit RO 0.8.
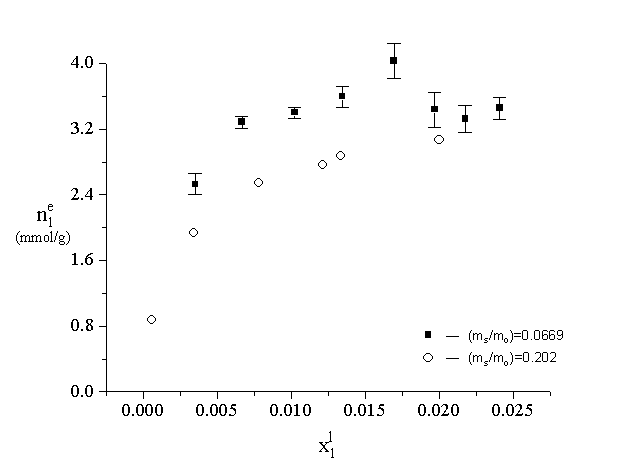
Figure 3.
The adsorption isotherm of 1-propanol from dilute aqueous solution on Norit RO 0.8 at two, fixed values of adsorbent mass to mass of the solution phase ratio (at 25 oC). The confidence intervals of the specific surface excess (at a =0.05) were estimated on the basis of repeated experiments. In the case of (ms/mo)=0.202 the confidence intervals were not plotted, because they are commensurable with the size of the open circles.
The values and confidence intervals of the adsorbed amount were determined on the basis of repeated adsorption measurements. It is clearly seen, that the adsorption isotherms belonging to the two values of sorbent “concentration” are significantly different. So in the investigated adsorption system the extent of adsorption depends not only on the equilibrium concentration but on the fixed values of initial concentration or sorbent “concentration”.
Equilibrium or something else?
According to the laws of equilibrium thermodynamics it can be proved that the equilibrium adsorption isotherms referring to the adsorption of binary mixtures must be unequivocal function of the equilibrium concentration of the solution phase at constant temperature and pressure. So our experimental results seem to be in contradiction with the principles of thermodynamics. However it could be shown, that the adsorption of 1-propanol from dilute aqueous solution onto activated carbon did not belong to the clear phenomenon of equilibrium physical adsorption of binary mixtures.
According to proper control experiments it can be stated, that the examined adsorption system is not reversible at 25 oC and depends on the route of attaining the final state of the system. The spatial and temporal homogeneity of the intensive variables can be explained with the existence of different metastable states belonging to different initial concentrations of the supernatant. The kinetic constraints which “froze” our system in metastable states disappear on elevated temperatures. This is shown by the fact, that the adsorption isotherm of 1-propanol does not depend on the sorbent “concentration” at 65 Co.
For the interpretation of metastability a simple model was proposed. The most important assumption of this model is the existence of a given amount of metastable water on the surface, which is excluded from the dynamic process of the adsorption. If this amount of water molecules depends of the initial concentration, then the surprising experimental observations could be interpreted in quite a simple way.
Publications
1. M. Nagy, Langmuir, 7 (1991) 343.
2. Nagy M. , Domján A., Mészáros R. Magyar Kémiai Folyóirat, 11, (1995) 460.
3. R. Mészáros, M. Nagy, and G. Veress Adsorption Science and Technology 13, (1996) 327.
4. R. Mészáros, M. Nagy, and G. Veress Adsorption Science and Technology 13, (1996) 341.
| Vissza a tartalomjegyzékhez Back to Contents |
Vissza a PhD-tézisek tartalomjegyzékhez Back to PhD theses list |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |