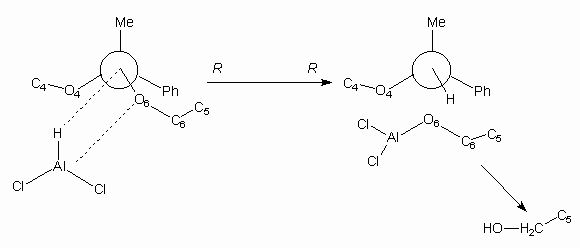
Scheme 1a
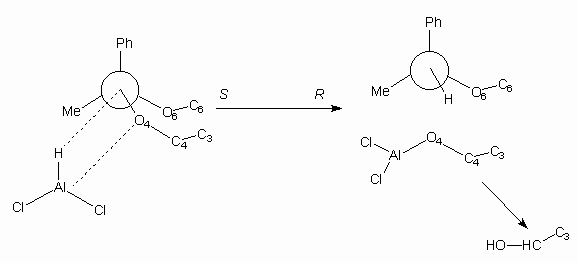
Scheme 1b
Szénhidrát-acetálok szintézise és hidrogenolízise
Kossuth Lajos Tudományegyetem, Debrecen
1997
A dolgozat elsõ részében a korábban elõállított 4,6-O-(1-fenil-etilidén)-acetálok gyûrûnyitásánál tapasztalt nagyfokú regio- és sztereoszelektivitást vizsgáltuk.
Ezen acetálok hidrogenolízise során képzõdött éterek acetálos szenét elõzetesen R konfigurációjúnak feltételezték. Az (S)-acetálokból képzõdött 6-O-(1'-fenil-etil)-éterek esetén az abszolút konfiguráció meghatározását egyszerû kémiai reakciókkal végeztük.
A 4-O-(1'-fenil-etil)-éterek esetében kémiailag csak azt bizonyítottuk, hogy ha az (R)-acetálok hidrogenolízise során két-két diasztereoizomer képzõdött volna, akkor azokat kromatográfiás és spektrális szempontból meg tudtuk volna különböztetni.
Az (1-fenil-etil)-csoporton kívül egyéb kromofort nem tartalmazó vegyületek, valamint az R(+)- ill. S(-)-1-fenil-etanol CD paramétereinek (De) összevetésével bizonyítottuk az (1-fenil-etil)-csoportok R konfigurációját.
A kísérleti adatok alapján az 1,3-dioxán-típusú (1-fenil-etilidén)-acetálok hidrogenolízisére egy ún. "négycentrumos"-mechanizmust feltételeztünk, ezzel az észlelt sztereoszelektivitás értelmezhetõnek bizonyult (lásd Scheme 1a, 1b az angol verzióban).
Az acetálok gyûrûnyitása regioszelektivitásának
tanulmányozásához elõállítottuk
a metil-2,3-di-O-benzil-a-D-glükopiranozid 4,6-O-benzilidén-,
-etilidén-, -metilén-, -izopropilidén-, -(difenil-metilén)-acetáljait.
A hidrogenolízis során nem, vagy csak kis mennyiségben
(max. 10%) képzõdtek a
6-O-éterek, azaz az acetálos szén szubsztituensétõl
gyakorlatilag független volt a redukció.
A királis centrumot hordozó szek-butilidén-acetálok diasztereoizomerjei egyaránt 4-O-szek-butil-étert eredményeztek, s a korábbi "négycentrumos"-mechanizmus alapján retenciót feltételeztünk.
A Biokémiai Tanszéken korábban már alkalmazott (difenil-metilén)-acetálokkal kapcsolatos kutatások folytatásaként a dolgozat második felében egy új, szimmetrikus acetált vizsgáltunk, melynek hidrogenolízise könnyen eltávolítható éterhez vezetett.
A szénhidrátkémiában ezeddig alig-alig alkalmazott (fluoren-9-ilidén)-acetálok jó hozamú szintézisét oldottuk meg bázikus közegben, 9,9-diklór-fluorénnel, s ily módon
nyertünk számos, a (fluoren-9-ilidén)-gyûrû szomszédságában szabad hidroxilcsoportot tartalmazó, hexo- és pentopiranozidot, valamint hexopiranózt, melyeket azután klór-alánnal reagáltattunk (lásd Scheme 2 az angol verzióban).
Az 1,6-anhidro-2,3-O-(fluoren-9-ilidén)-b-D-mannopiranóz esetében 3:2 arányban képzõdött az axiális és ekvatoriális (fluoren-9-il)-éter, míg a többi esetben kizárólag axiális (fluoren-9-il)-éterek képzõdtek közel kvantitatív hozammal.
A savas és bázikus körülmények között egyaránt stabil (fluoren-9-il)-éter diklór-alánnal, valamint katalitikus hidrogénezéssel hasítható, ami lehetõvé teszi, hogy a preparatív szénhidrátkémiában nagy jelentõségû benzilcsoport mellõl (AlHCl2) vagy azzal együtt (H2/Pd-C) eltávolítható legyen.
A figyelemre méltó regioszelektivitás miatt teljesen védett származékokat is elõállítottunk az acetálgyûrûvel szomszédos helyzetû OH alkilezésével. A metil-2,3-O-(fluoren-9-ilidén)-a-L-ramnopiranozid 4-O-benzil-, 4-O-allil-, 4-O-n-butil-, 4-O-etil- és 4-O-metil- származékát klór-alánnal hidrogenolizálva a korábbival ellentétes regioszelektivitást tapasztaltunk.
A fõtermékként kapott ekvatoriális (fluoren-9-il)-éterek képzõdését az acetálgyûrûvel szomszédos helyzetû szubsztituens sztérikus szerepével is magyarázhatnánk, de a 4-dezoxi-vegyület gyûrûnyitása sem bizonyult kivételnek, azaz a szabad hidroxilcsoport eszenciális szerepe biztosnak tekinthetõ.
A dezoxigenálást a megfelelõ xantogenát gyökös redukciójával (Bu3SnH/AIBN) végeztük, s a (difenil-metilén)-acetálnál korábban tapasztalt anomális fragmentáció, a két fenilgyûrû anellációja miatt, itt nem jelentkezett. Nem fragmentálódott a megfelelõ benzilidén-acetál (endo ill. exo) sem, és a képzõdött 4-dezoxi-vegyületek hidrogenolízise "szabályos" módon zajlott: az endo-fenil izomer elsõsorban axiális benzil-étert, míg az exo-fenil izomer fõleg ekvatoriális benzil-étert eredményezett.
A dioxolán-típusú benzilidén-acetáltól eltérõen a (fluoren-9-ilidén)-acetálok hidrogenolízisének nagyfokú szelektivitásához szükséges a szomszédos OH-csoport jelenléte, s a gyûrûnyitás mechanizmusára javaslatot tettünk (lásd Scheme 3 az angol verzióban).
Vizsgáltunk olyan vegyületeket is, ahol a szabad OH-csoport a dioxolángyûrû axiális oxigénjével szomszédos. Az 1,6-anhidro-b-D-galaktopiranózból kiindulva több galakto- ill. talo-vegyület (fluoren-9-ilidén)-acetálját elõállítottuk és hidrogenolizáltuk.
A redukciók termékarányai megerõsítették, hogy a szelektivitás alapfeltétele a "résztvevõ" szabad OH-csoport, valamint megállapítottuk, hogy a gyûrûnyitás irányát befolyásolhatja még acetálvándorlás ill. 1,3-diaxiális-kölcsönhatás is, azaz a hasításhoz szükséges intramolekuláris komplex kialakulása szempontjából ezeket a tényezõket is figyelembe kell venni.
Synthesis and hydrogenolysis of carbohydrate acetals
Ph.D. thesis, Lajos Kossuth University, Debrecen
1997
The hydrogenolysis (reductive cleavage) of the previously described diastereoisomeric 4,6-O-acetophenone ketals with the LiAlH4/AlCl3 reagent showed high regio- and stereoselectivity: the R-isomers gave 4-O-(1'-phenylethyl) ethers the corresponding S-isomers produced the respective 6-O-(1'-phenylethyl) ethers. The formation was detected in each case of a single diastereoisomer, whose absolute configuration was supposed to be R.
For the determination of the absolute configuration of the 6-O-(1'-phenylethyl) ethers simple chemical reactions were carried out.
Since it appeared rather tedious to find similar convincing chemical evidence in the case of the 4-O-(1'-phenylethyl) ethers, our only goal was distinguish between the two diastereoisomers occasionally produced upon hydrogenolysis of the R-isomers by applying both chromatographic and spectroscopic methods.
The final determination of the configuration was carried out by circular dichroism measurements. The CD parameters of (R)-(+)- and (S)-(-)-1-phenylethanol were measured and compared with those of 4-O- and 6-O-phenylethyl ethers. The results unequivocally prove that the configuration of the newly developed chiral centre is R.
On the basis of our experimental facts a four-centre intermediary state was suggested for the explanation of the stereoselectivity (see Scheme 1a and 1b).

Scheme 1a

Scheme 1b
For studying factors influencing the regioselectivity of the hydrogenolysis of acetals and ketals the following compounds were carried out: 4,6-O-benzylidene, -ethylidene, -methylene, -isopropylidene, -diphenylmethylene acetals of methyl 2,3-di-O-benzyl-a-D-glucopyranoside. Hydrogenololysis of these acetals gave only a small amount (max. 10%) 6-O-ethers, so the reduction was not influenced by the substituent of acetal carbon.
Hydrogenolysis of diasteromeric sec-butylidene acetals resulted in 4-O-sec-butyl ethers. According to the reaction mechanism proposed for the acetophenone derivatives the absolute configuration of the sec-butyl ethers produced can also be determined. The preparation and stereoselective hydrogenolysis of diphenylmethylene acetals had been reported, and now we described the synthesis of dioxolane-type fluoren-9-ylidene acetals and their hydrogenolysis to fluoren-9-yl ethers. These syntheses were carried out with 9,9-dichlorofluorene under basic conditions (see Scheme 2).
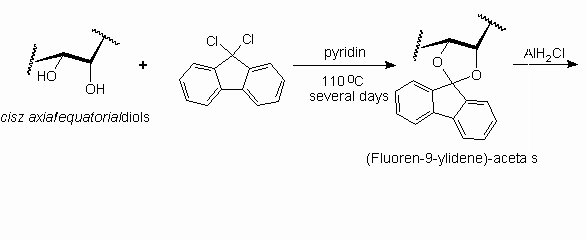
Scheme 2
Hydrogenolysis of free OH containing fluoren-9-ylidene acetals of hexo- and pentopyranosides as well as hexopyranose with AlClH2 gave axial ether derivatives; the only exception was 1,6-anhydro-2,3-O-(fluoren-9-ylidene)-b-D-mannopyranose, which gave a 3:2 mixture of axial and equatorial ethers.
The fluoren-9-yl ethers are stable under basic and acidic conditions, but they can be removed by hydrogenolysis either with AlHCl2 or H2-Pd/C, and may prove to be useful protecting groups.
All of above described derivatives contained a free OH group in the vicinity of the dioxolane ring. To extend the synthetic efficacy of these easily transformable symmetric ketals we decided to investigate the fully protected derivatives of different fluoren-9-ylidene acetals of hexopyranosides.
In order to study the applicability and versatility of dioxolane-type fluoren-9-ylidene acetals as a new protective group we assayed the alkylation of methyl 2,3-O-fluoren-9-ylidene-a-L-rhamnopyranoside (4-O-benzyl, -allyl, -n-butyl, -ethyl, -methyl derivatives were prepared). Hydrogenolysis of these compounds followed opposite cleavage pattern. Hydrogenolysis of methyl 4,6-dideoxy-2,3-O-fluoren-9-ylidene-a-L-lyxo-hexopyranoside completely precluded the role of the substitution of OH-4 because, again, the 3-O-ether dominated suggesting the essential role of the free OH group in all investigated cases.
The corresponding xanthate ester was deoxygenated (Bu3SnH/AIBN) without any fragmentation because of anellation of phenyl rings.
Radical rearrangement of benzylidene acetals (endo and exo) was also not observed and hydrogenolysis of isomeric benzylidene acetals containing a neighbouring deoxy function followed "normal" pattern: endo isomer gave axial benzyl ether and exo isomer resulted in equatorial benzyl ether as main product. An acceptable explanation of the high stereoselectivity of the cleavage of the OH group-containing fluoren-9-ylidene acetals was suggested (see Scheme 3).
All ketals investigated up to now contained a free OH group located in gauche arrangement to the equatorial oxygen of the dioxolane ring. The synthesis of 1,6-anhydro-3,4-O-fluoren-9-ylidene-b-D-galactopyranose and talopyranose derivatives provided a new type of ketals, the free OH-2 was located in the vicinity of the axial oxygen of the dioxolane ring. These compounds were also reduced by chloroalane.
These investigations clearly show the cooperation of different parameterswhich determine the outcome of the ring cleavage reaction, such as complex formation and orientation of the hydride reagent, the configurational arrangements of the free ("participating") OH group to one of the oxygen atoms of the dioxolane ring, acetal migration as well as a very important role of the conformational relationship of the rings presents in the 1,6-anhydro-derivatives. The balance of these influencing parameters has to be taken into account to predict the direction of the hydrogenolytic ring cleavage of the symmetric ketal derivatives.
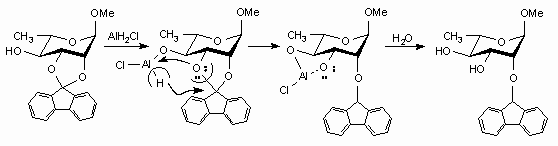
Scheme 3
Publications
1. J. Hajkó, A. Borbás, M. Kajtár-Peredy, and A. Lipták: Preparation of dioxolane-type fluoren-9-ylidene acetals of carbohydrates and their hydrogenolysis with AlClH2 to give axial fluoren-9-yl ethers. Carbohydr. Res., 216 (1991), 413-420.2. A. Borbás, J. Hajkó, M. Kajtár-Peredy, and A. Lipták: Hydrogenolysis of dioxolane-type diphenylmethylene acetals by AlClH2 to axial diphenylmethyl ethers. J. Carbohydr. Chem., 12 (1993), 191-200.
3. J. Hajkó, G. Szabovik, J. Kerékgyártó, M. Kajtár, and A. Lipták: Hydrogenolysis of the 4,6-O-ketals of glucopyranosides. Configuration-dependent high regio- and stereo-selectivity of the diastereoisomeric acetophenone derivatives. Aust. J. Chem., 49 (1996), 357-363.
4. J. Hajkó, A. Borbás, G. Szabovik, M. Kajtár-Peredy, and A. Lipták: Synthesis and hydrogenolysis of dioxolane-type diphenylmethylene and fluoren-9-ylidene carbohydrate acetals containing a neighbouring substituted hydroxyl function. J. Carbohydr. Chem., 16 (1997), 1123-1144.
| Vissza a tartalomjegyzékhez
Back to Contents |
Vissza a PhD-tézisek tartalomjegyzékhez
Back to PhD theses list |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |