Szentirmay Éva
Az 1a-etil-1b-(meziloxi-metil)-1,2,3,4,6,7,12,12bb-oktahidroindolo[2,3-a] kinolizin reakciója N, S- és ambidens nukleofilekkel
Budapesti Mûszaki Egyetem
1996
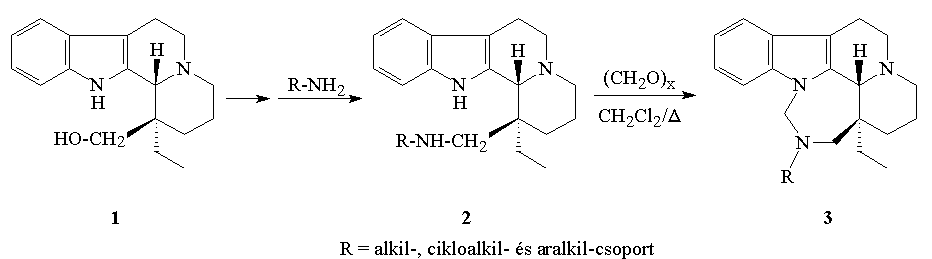
A BME Szerves Kémia Tanszékén mûködõ Alkaloidkémiai Kutatócsoportban a 70-es évek elején szintézist dolgoztak ki a (hidroxi-metil)-oldalláncot tartalmazó indolokinolizin származék (1) elõállítására, amelynek balra forgató antipódja [(-)-1] azóta potenciális gyógyszermolekulává vált (Vintoperol). Feladatom a hidroxi-vegyület N- és S-tartalmú származékainak szintézise volt a szerkezet-hatás összefüggések tanulmányozása és új, nagyobb hatású vegyületek elõállítása céljából. Az 1 mezilészterének nukleofilekkel, azokon belül is elõször primer aminokkal szembeni viselkedését tanulmányoztam, majd a kapott szekunder aminokat (2) intramolekuláris Mannich-reakcióban 15-aza-E-homoeburnán származékokká (3) alakítottam. Néhány aromás amin esetében érdekes, nem várt mellékreakciókat figyeltem meg.

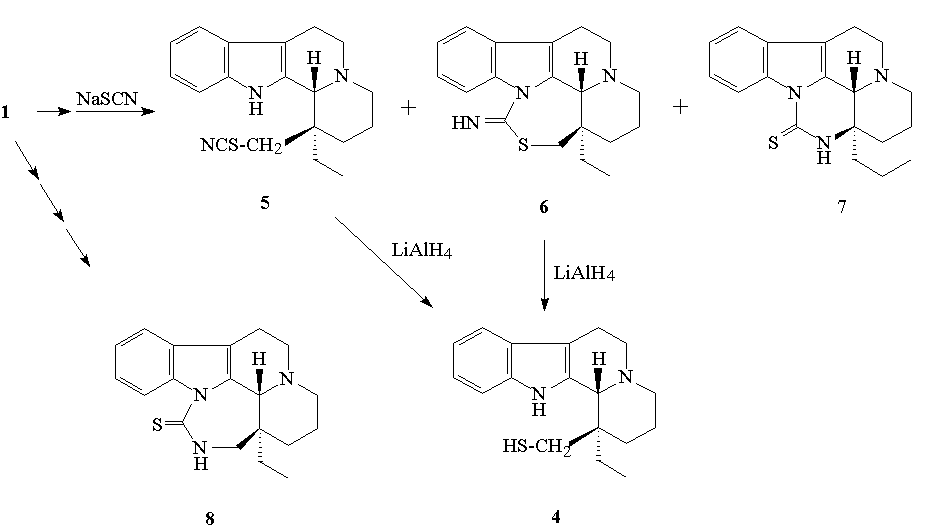
A munka második részében az 1 hidroxi-vegyület tioanalogonjának (4) különbözõ utakon történõ elõállítását végeztem el. Ennek kapcsán a mezilésztert különféle S- és ambidens nukleofilekkel reagáltattam, melyek közül legérdekesebbnek a tiocianát ionnal végzett reakció bizonyult. Az átalakítás során nyert három termék (5, 6, 7) közül kettõt, az 5 tiocianátot és a 6 imino-homo-tiaeburnán származékot redukálva eljutottam a 4 célmolekulához. Független úton elõállítottam a 6 szerkezeti izomerjét, a 8 tioxoeburnán származékot.
Reaction of 1a-ethyl-1b<-(mesyloxymethyl)-1,2,3,4,6,7,12,12bb-octahydro-indolo [2,3-a] quinolizine with N-, S- and ambinent nucleophiles
Ph.D. thesis, Technical University of Budapest
1996
Some years ago Prof. Szantay's research group discovered the favourable vasodiloator and angioprotective activities of (-)-1 (Vintoperol). The aim of these theses was the investigation of the nucleophilic substitution reactions of the racemic hydroxymethyl compound 1 (see in the Hungarian text). Its mesylate ester was reacted with several primary amines and secondary amino derivatives 2 were prepared, which intramolecular Mannich-reaction gave 15-aza-E-homoeburnane derivatives 3. Some interesting unexpected ring-transformations were observed in the case of certain aromatic amines.
In the second part of the work the racemic hydroxy-methyl compound was converted to its mercapto derivative (4) in various ways. The reaction of the mesylate ester of 1 with ambident nucleophiles yielded several products. When it was made react with thiocyanate, three products (5, 6 and 7) were obtained. The thiocyanato derivative 5 and the imino-homo-thiaeburnane 6 were reduced to the thiol 4. In an independent way, the aza-homo-eburnane derivative 8, the structural isomer of 6 was also synthesized.
Publications
György Kalaus, Éva Szentirmay, Mária Kajtár-Peredy, János Brlik, Lajos Szabó and Csaba Szántay: Synthesis of Vinca Alkaloids and Related Compounds, LXXIV. Reaction of (± )-1a-Ethyl-1b-(mesyloxymethyl)-1,2,3,4,6,7,12,12bb-octahydro-indolo[2,3-a] quinolizine with Hydride and N-nucleophiles, Journal of Chemical Research (S) 1995, 382.; Journal of Chemical Research (M) 1995, 2233-2259.
György Kalaus, Éva Szentirmay, Mária Kajtár-Peredy, János Brlik, Lajos Szabó and Csaba Szántay: Synthesis of Vinca Alkaloids and Related Compounds, LXXV. Reaction of (±) -1a-Ethyl-1b-(mesyloxymethyl)-1,2,3,4,6,7,12,12bb-octa-hydro-indolo[2,3-a] quinolizine with Ambident- and S-nucleophiles, Journal of Chemical Research (S) 1995, 383.; Journal of Chemical Research (M) 1995, 2260-2281.
198.927 sz. magyar szabadalom, C.A. 112: 172337n (1990); Dr Hajós György, Dr Kalaus György, Dr Matuz Judit, Dr Szabó Lajos, Dr Szporny László, Dr Szántay Csaba, Dr Sághy Katalin, Ezer Elemér, Szentirmay Éva, Székely Krisztina: Eljárás 1-(szubsztituált amino-metil)-oktahidro-indolo[2,3-a]kinolizin származékok, gyógyászatilag alkalmazható savaddíciós sóik, valamint az ezeket tartalmazó gyógyszerkészítmények elõállítására
| Vissza a tartalomjegyzékhez Back to Contents |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |