Br + neo-C5H12 >neo-5H11 + HBr ( 1)
Br + C2H6>
2H5 + HBr ( 2)
Br + CH3Br >
H2Br + HBr ( 3)
Br + CH2BrCl >
HBrCl + HBr ( 4)
Br + CCl3CHO > CCl3
O + HBr ( 5)
Br + C2H5CHO > C2H5
O + HBr ( 6)
Brómatomok gázfázisú elemi reakcióinak kinetikai vizsgálata
Eötvös Loránd Tudományegyetem Budapest*
1999
I. Bevezetés
A Br-atom gázfázisú elemi reakciói számos összetett kémiai folyamat mechanizmusában központi szerepet játszanak. Ezek között alapkutatási és gyakorlati szempontokból fontos reakciók egyaránt találhatók. Ilyen például a bróm hidrogén kémiai láncreakció, amelynek kutatása döntõ mértékben hozzájárult a reakciókinetika tudományának megalapozásához. Ugyancsak fontos a szerves vegyületek fotobrómozásának kinetikai vizsgálata, ami napjainkig az egyik legfontosabb eszköz a szabadgyökök termokémiai adatainak meghatározásában.
Az utóbbi évtizedekben a halogéntartalmú anyagok légkörkémiai szerepének felismerése újabb lendületet adott a brómatom-reakciók kutatásának. A sztratoszférába kerülõ klór- és brómtartalmú anyagok fotolízise során keletkezõ halogénatomok károsítják az ózonpajzsot, kémiai láncreakciókon keresztül. Az újabb kutatási eredmények azt mutatják, hogy a Br-atomok még a Cl-atomoknál is hatékonyabbak az ózon elbontásában. Az említett összetett kémiai folyamatok pontos leírásához nélkülözhetetlen a mechanizmusokban szerepet játszó elemi reakciók kinetikai és termokémiai jellemzõinek ismerete. Ehhez kívántam hozzájárulni értekezésemben leírt kutatások elvégzésével.
A vizsgálatok közvetlen céljai alapkutatási természetûek voltak: (i) eddig nem, vagy nem kellõ pontossággal ismert sebességi együtthatók és Arrhenius paraméterek (preexponenciális tényezõk és aktiválási energiák) meghatározása; (ii) a szubsztituensek hatásának vizsgálata a reaktivitásra a Br-atom reakciók körében; (iii) szabadgyökök képzõdési entalpiájának meghatározása reakciókinetikai módszerekkel; (iv) a különbözõ kísérleti módszerekkel kapott eredmények összehasonlítása.
Az alábbi elemi reakciók részletes kinetikai vizsgálatát végeztem el:
Az alapkutatási szempontokon túlmenõen, a vizsgálatokra kiválasztott (1)-(6) elemi reakciók között szerepelnek olyanok, amelyek önmagukban fontosak légkörkémiai szempontokból. A többi reakció kinetikai vizsgálatán keresztül az égési és légkörkémiai folyamatok mechanizmusában fontos szerepet játszó szabadgyökök képzõdési entalpiáinak meghatározása vált lehetõvé.Br + neo-C5H12 >neo-5H11 + HBr ( 1)
Br + C2H6>
2H5 + HBr ( 2)
Br + CH3Br >
H2Br + HBr ( 3)
Br + CH2BrCl >
HBrCl + HBr ( 4)
Br + CCl3CHO > CCl3
O + HBr ( 5)
Br + C2H5CHO > C2H5
O + HBr ( 6)
II. Kísérleti módszerek
A reakciókinetikai vizsgálatokat két kísérleti módszerrel végeztem. Legtöbbször egy lézer-impulzus fotolízist és rezonancia-fluoreszcenciás detektálást alkalmazó ún. közvetlen kísérleti módszert használtam (LF / RF módszer). Összehason-lításul és a hõmérséklet-tartomány kiterjesztése céljából alkalmaztam ezen kívül a hagyományosabb vonatkoztatási reakciók módszerét is (VR módszer).
Az lézer-impulzus fotolízis / rezonancia-fluoreszcencia kísérleti eljárás a Br-atom koncentrációjának közvetlen mérésén alapul a reakcióidõ függvényében. A Br-atomok elõállítása a megfelelõ gyökforrásból (CF2Br2 vagy CH3Br) 248 nm-es hullámhosszú lézer impulzusokkal történt. A Br-atomok gerjesztésére egy mikrohullámú generátorral mûködtetett Br-rezonancia lámpa szolgált. Az indukált rezonáns fényt egy speciális (solar blind) fotoelektron-sokszorozó észlelte. A brómatom-koncentrációval arányos RF-jel idõbeli lecsengése alapján a reakciók bruttó sebességi együtthatóját, kb, határoztam meg pszeudo-elsõrendû körülmények között az RH reaktáns nagy feleslegében ([RH] >>[Br]0):
A másik (VR) módszerrel sebességi együttható viszonyok határozhatók meg. Ebben az esetben a Br-atom vizsgált reakciója (x) a Br-atom egy másik reaktánssal végbemenõ reakciójával (v) hasonlítható össze a reakciótermékek (R1Br és R2Br) képzõdési sebességének mérése útján:
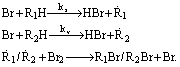
A kx / kv sebességi együttható
viszony a vonatkoztatási reakció kinetikai paramétereinek
ismeretében bontható fel. A VR-kísérletek egy
gázküvettában történtek, amelyben a reaktánsok
elegyét (Br2 / R1H / R2H / He)
adott hõmérsékleten egy nagynyomású
higanygõz-lámpa folytonos fénye sugározta be.
A reakciótermékeket rendszeres idõközönként
vett minták gázkromatográfiás elemzésével
határoztam meg.
III. Kutatási eredmények
A kutatásaimban meghatározott kinetikai és termokémiai
mennyiségeket az 1. táblázatban foglaltam össze.
1. A Br + neopentán (1) reakció
A szénhidrogének gázfázisú brómozási folyamata régóta tárgya a reakciókinetikának. A Br + neopentán (1) reakcióra vonatkozóan azonban napjainkig még nem végezték el a kinetikai paraméterek meghatározását közvetlen kísérleti módszerek alkalmazásával.
Az (1) reakció kinetikáját a lézer-impulzus fotolízis / rezonancia-fluoreszcencia és a vonatkoztatási reakciók módszerével is tanulmányoztam.
Az LF / RF kísérletek eredményeként megállapítottam, hogy a vizsgált 688-775 K hõmérséklet-tartományban meghatározott sebességi együtthatók hõmérséklet-függése jól leírható az Arrhenius összefüggéssel, amely a következõképpen adható meg (a feltüntetett hibák (n- 1)-gyel osztott empirikus szórások):
k1 = (6,89 ± 2,27) · 1014 exp[- (57,61 ± 2,05) kJ mol-1/ RT] cm3 mol-1s-1.
A VR módszerrel végzett kinetikai vizsgálatokat a Br + etán (2) reakció, mint vonatkoztatási reakció alkalmazásával kb. 1000 mbar össznyomáson He inert gázban, 298 K hõmérsékleten hajtottam végre. Eredményül az alábbi sebességi együttható viszonyt adtam meg [2]:
k1 / k2 = 0,83 ± 0,21.
1. Táblázat. A meghatározott kinetikai és termokémiai mennyiségek összefoglalása
|
|
cm3 mol-1 s-1 |
cm3 mol-1 s-1 |
EA(± 1s )
kJ mol-1 |
Megjegyzés |
|
|
|
|
|
38 ± 6 kJ mol-1 |
|
|
|
|
|
0,83 ± 0,21 |
|
|
|
|
|
175,6 ± 1,8 kJ mol-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cm3 mol-1s-1 |
A reakciókinetikai irodalomban eddig még közvetlen kísérleti módszerrel meghatározott kinetikai paramétereket nem közöltek a Br + neopentán (1) reakcióra vonatkozóan. Az egyetlen kísérleti adatot Fettis és munkatársai [5] írták le ami hibahatárokon belül jól egyezik a fenti eredménnyel.
Egy szakirodalomból átvett k2 sebességi együttható érték [6] felhasználásával felbontható a VR-vizsgálatokban kapott k1 / k2 viszony és megadható a Br + neo-C5H12 (1) reakció sebességi együtthatója szobahõmérsékleten:
k1 (298 K) = (5,3 ± 5,2)·104 cm3 mol-1 s-1.
Ez igen jó egyezésben van a közvetlen, LF / RF módszerrel meghatározott sebességi együttható kifejezés alapján számítható értékkel, figyelembe véve a kinetikai adatok hõmérsékleti extrapolációjából származó jelentõs bizonytalanságokat:
k1 (298 K) = (5,6 ± 5,0)·104 cm3 mol-1 s-1 .
A két alapvetõen különbözõ kísérleti technikával meghatá-rozott k1(298 K) értékek jó egyezése az eredmények megbízhatóságát támasztja alá. Az LF / RF és a VR vizsgálatok együttes eredményeként a 298-775 K hõmérséklet-tartományban a sebességi együttható kifejezésére a következõ háromparaméteres összefüggést javasoltam:
k1 = (8,5 ± 1,8)·109 ·T 1,5 exp[- (49,0 ± 1,3) kJ mol-1/ RT] cm3 mol-1 s-1.
2. A Br + brómmetán reakció
A légkör brómtartalmú vegyületei közül legnagyobb koncentrációban a brómmetán fordul elõ. Kinetikai sajátságainak feltárása alapvetõ fontosságú a légkör brómkémiájának megismerése szempontjából, ami összefügg a Földet védõ ózonréteg elvékonyodásának problémájával.
A Br + CH3Br (3) reakció kinetikai vizsgálatát mindkét (LF / RF és VR) kísérleti módszer alkalmazásával elvégeztem.
Az LF / RF vizsgálatok, 160-180 mbar nyomáson, He inert gázban történtek. A Br-atomok elõállítására közvetlenül a CH3Br lézer-impulzus fotolízise szolgált. A vizsgált 720-777 K hõmérséklet-tartományban, a sebességi együttható hõmér-séklet-függése követi az Arrhenius törvényt:
k3 = (9,6 ± 1,3)·1013 exp[- (68,6 ± 1,7) kJ mol-1/ RT] cm3 mol-1 s-1.
A kapott A-faktor összhangban van a szénhidrogénekre közvetlen kísérleti módszerrel meghatározott A-faktorokkal, az aktiválási energia jelentõsen, mintegy 8 kJ / mol-lal kisebb, mint a Br + CH4 reakció aktiválási energiája.
A fenti sebességi együttható tekinthetõ az elsõ, közvetlen módszerrel meghatározott kinetikai eredménynek a Br + CH3Br (3) reakcióra vonatkozóan. A szakirodalomban ezen kívül csak a hagyományos termikus- és fotobrómozási vizsgálatokból származtatott sebességi együtthatók és sebességi együttható viszonyok állnak rendelkezésre. Ezek kritikai elemzése alapján javasolt egy sebességi együttható kifejezést Amphlett és Whittle [7], ami jól egyezik fenti eredményemmel.
A VR kinetikai módszer alkalmazásával a Br + CH3Br (3) reakció sebességét a Br + CH2BrCl (4) reakció sebességével hasonlítottam össze gázkromatográfiás végtermék-analízisek alapján. A kísérletek He inert gáz alkalmazásával, 100-400 mbar nyomáson zajlottak. Megállapítottam, hogy a meghatározott k3 / k4 sebességi együttható viszony hõmérsékletfüggése a vizsgált 353-410 K hõmérséklet-tartományban leírható az Arrhenius egyenlettel, ami a következõ:
k3 / k4 =(1,63 ± 0,12) exp [(15,6 ± 0,4) kJ mol-1/ RT].
A k3 / k4 sebességi együttható viszony nõ a hõmérséklet növekedésével, jeléül annak, hogy a (3) reakció aktiválási energiája nagyobb a (4) reakcióénál.
A Br + CH2BrCl (4) reakcióra vonatkozóan nem szerepel kinetikai adat a szakirodalomban. A dolgozat beadásának idõpontjáig a (4) reakció LF / RF kísérleti vizsgálatainak lezárására még nem került sor. A k4 sebességi együttható közelítõ pontossággal megadható azonban a k3 / k4 viszony és a k3 sebességi együtthatóra az LF / RF vizsgálatokból kapott eredmény alapján:
k4 ~5,9· 1013 exp[- (53,0) kJ mol-1/ RT ] cm3 mol-1 s-1 .
3. A Br + triklór-acetaldehid és a Br + propionaldehid reakció
A propán és az ipari oldószerként használt metil-kloroform légköri lebomlása során propionaldehid ill. triklór-acetaldehid keletkezik reakció-köztitermékként. A két aldehid Br-atommal végbemenõ légköri reakciójának szerepe lényegesen jelentõsebb lehet a korábban feltételezettnél. Ezzel kapcsolatban azonban csak nagyon kevés reakciókinetikai vizsgálatot végeztek.
A Br + triklór-acetaldehid (5) reakció sebességi együtthatójának meghatározása 298 és 450 K hõmérsékleten, a Br + propionaldehid (6) reakcióé 298 K-en a közvetlen, LF / RF kísérleti módszer alkalmazásával történt.
A bróm + triklór-acetaldehid (5) reakció tanulmányozása során megállapítottam, hogy a 298 K-en végzett kísérletekben zavaró mértékben végbement az aldehid fotolízise, ami a meghatározott sebességi együttható felülmérését eredményezte. A 450 K-en végzett kísérletekben ez a probléma, a CCl3CHO reaktáns lényegesen kisebb koncentrációja miatt már elhanyagolható volt. Így a következõ sebességi együtthatót határoztam meg [1]:
k5(450 K) = (9,80 ± 1,01)·109 cm3 mol-1s-1.
Ennek, egy szakirodalmi adatok alapján feltételezett A-faktor [8] felhasználásával szobahõmérsékletre extrapolált értéke:
k5(298 K)![]() 1·109
cm3
mol-1s-1.
1·109
cm3
mol-1s-1.
Reakciókinetikai vizsgálataim alapján a Br + propionaldehid (6) reakció sebességi együtthatójára a következõ szobahõmérsékletû értéket határoztam meg az LF / RF módszerrel [1]:
k6(298 K)= (3,90 ± 0,40)·1012 cm3 mol-1s-1.
A javasolt érték jól egyezik a gyorsáramlásos kísérleti módszerrel kapott adattal, amelyet kutatóhelyünkön a vizsgálataimmal egy idõben határoztak meg munkatársaim.
Az eredmények alapján megállapítható,
hogy a Br-atom meglepõen nagy sebességi együtthatóval
reagál alifás-aldehidekkel. Ezzel szemben a Br + CCl3CHO
(5) reakcióra meghatározott sebességi együttható
nagyságrendekkel kisebb. A (6) reakció nagy sebességi
együtthatója azt jelenti, hogy a propionaldehid reakciója
Br-atommal számottevõ jelentõségû légköri
körülmények között összehasonlítva
az OH-gyökkel végbemenõ fõ reakcióval.
Speciális viszonyok mellett ez a legfontosabb iniciálási
lépése a propionaldehid légköri lebomlásának.
4. A neopentilgyök és a brómmetilgyök képzõdési entalpiája
A neo-![]() 5H11-gyök
a többszénatomos primer alkilgyökök prototípusának
tekinthetõ. A
5H11-gyök
a többszénatomos primer alkilgyökök prototípusának
tekinthetõ. A ![]() H2Br-gyök
a brómmetán légköri lebomlásának
elsõ lépésében képzõdik, amely
azután számos elemi reakcióban reagál tovább,
és így központi szerepet játszik a légkör
brómkémiájában.
H2Br-gyök
a brómmetán légköri lebomlásának
elsõ lépésében képzõdik, amely
azután számos elemi reakcióban reagál tovább,
és így központi szerepet játszik a légkör
brómkémiájában.
A neopentilgyök képzõdési entalpiáját az ún. II. fõtétel analízis segítségével származtattam. Ennek során a
Br + neo-C5H12reakcióban bekövetkezõ entalpiaváltozást a felsõ és az alsó nyíl irányába végbemenõ reakciók aktiválási entalpiájának különbségével adtam meg. A reakció szabadentalpia-változását az egyensúlyi állandó, K = k1 / k-1, ismeretében számítottam. A reakcióban résztvevõ többi speciesz képzõdési entalpiájának és hõkapacitás függvényeinek ismeretében kiszámítottam a neopentilgyök moláris standard képzõdési entalpiáját.neo-
5H11 + HBr
A képzõdési entalpia származtatásához
ismerni kellett a neo-![]() 5H11
+ HBr (1) reakció kinetikai paramétereit, amelyeket irodalmi
adatok hiányában becsültem. A becslést a
5H11
+ HBr (1) reakció kinetikai paramétereit, amelyeket irodalmi
adatok hiányában becsültem. A becslést a ![]() 2H5
+ HBr (2) reakció kinetikai paramétereivel végeztem.
Az etilgyök + hidrogén-bromid reakciójára vonatkozóan
jelentõsen eltérõ kinetikai adatok szerepelnek az
irodalomban, ezért a becslést valamennyi adattal elvégeztem.
A számításokban kapott eredmények átlagát
javasoltam a neopentilgyök képzõdési entalpiájaként:
2H5
+ HBr (2) reakció kinetikai paramétereivel végeztem.
Az etilgyök + hidrogén-bromid reakciójára vonatkozóan
jelentõsen eltérõ kinetikai adatok szerepelnek az
irodalomban, ezért a becslést valamennyi adattal elvégeztem.
A számításokban kapott eredmények átlagát
javasoltam a neopentilgyök képzõdési entalpiájaként:
DfHo 298
(neo-![]() 5H11)
= 38 ± 6 kJ mol-1.
5H11)
= 38 ± 6 kJ mol-1.
A javasolt képzõdési entalpia érték jól egyezik az irodalomban általánosan elfogadottal [5], de az eredményt csak nagy hibahatárokkal tudtam megadni. A képzõdési entalpia ismeretében megadható a neopentán molekulában a C-H kötés disszociációs entalpiája, ami a következõ:
DHo ((CH3)3(C)H2C-H) = 425 ± 6 kJ mol-1.
A brómmetilgyök képzõdési entalpiáját ugyancsak a II. fõtétel analízis módszerével származtattam.
A fordított irányú (3) reakció kinetikai paramétereit J. A. Seetula kutatócsoportunkkal együttmûködésben határozta meg, amely eredményt a számításokban felhasználtam. ABr + CH3BrH2Br + HBr
D fHo 298(![]() H2Br)
= 175,6 ± 1,8 kJ mol-1
H2Br)
= 175,6 ± 1,8 kJ mol-1
értéket állapítottam meg, ami a brómmetán molekulában a
DHo 298 (BrH2C -H) = 433,3 ± 1,9 kJ mol-1
kötésdisszociációs entalpiának felel meg.
A javasolt D fHo
298(![]() H2Br)
érték rendkívül jól egyezik a különbözõ
termokémiai gyûjteményekben és kézikönyvekben
szereplõ adattal [5], ami reakciókinetikai mérésekbõl
származik, és kielégítõen egyezik a
fotoionizációs-tömegspektrometriás és
elméleti módszerekkel kapott entalpia adatokkal [10].
H2Br)
érték rendkívül jól egyezik a különbözõ
termokémiai gyûjteményekben és kézikönyvekben
szereplõ adattal [5], ami reakciókinetikai mérésekbõl
származik, és kielégítõen egyezik a
fotoionizációs-tömegspektrometriás és
elméleti módszerekkel kapott entalpia adatokkal [10].
A meghatározott kötésdisszociációs entalpiák primer C-H kötésekre vonatkoznak. Ezek alapján, irodalmi adatokkal összehasonlítva az állapítható meg, hogy a neopentán molekulában a C-H kötések erõssége közel megegyezik az etánéval. Ennek ismeretében valószínû, hogy a több szénatomos alkánok primer C-H kötései is közel hasonló erõsségûek. Ezzel szemben a Br-atom szubsztitúció jelentõsen csökkenti a C-H kötésdisszociációs entalpiát a metán molekulával összehasonlítva.
DHo 298
(H3C-H) = 439 kJ mol-1
DHo 298
(BrH2C-H) = 433 kJ mol-1,
DHo 298 ((CH3)H2C-H)
= 423 kJ mol-1
DHo ((CH3)3(C)H2C-H)
= 425 kJ mol-1.
5. A molekulaszerkezet és reaktivitás kapcsolatok a vizsgált Br-atom reakciók körében
A kutatásaimban meghatározott, valamint irodalmi reakciókinetikai és termokémiai adatok alapján vizsgáltam a szerkezet- és reaktivitás kapcsolatát. Megállapítottam, hogy a Br-atom szénhidrogénekkel végbemenõ reakciójában a reakciókészséget elsõsorban a reakciók termokémiai sajátságai határozzák meg, míg a szubsztituált acetaldehidek esetében a reakciók átmeneti állapotának polaritása a meghatározó tényezõ.
A brómatom reakciójára szénhidrogénekkel érvényes az Evans-Polányi szabály: a reakciók sebességi együtthatójának logaritmusa (a reakciók aktiválási energiája) lineárisan nõ a felhasadó kötés disszociációs entalpiájának csökkenésével. A tapasztalt lineáris összefüggés felhasználható pl. a Br-atom nem ismert sebességi együtthatójának becslésére, amennyiben ismerjük a reakció végbemenetelének során felhasadó C-H kötés disszociációs-entalpiáját.
A Br-atom nagyságrendekkel gyorsabban reagál alkilszubsztituált aldehidekkel, mint halogénszubsztituált aldehidekkel. A hatás csak kisebb részben magyarázható a reakcióentalpia változásával, mivel az R(CO)-H kötésdisszociációs entalpiák csak kevéssé változnak a reakciósorban. Jól értelmezhetõ viszont a reaktivitás alakulása a Br-atom elektrofil természetével és a reakciók átmeneti állapotának polaritásával. Az elektronküldõ alkil-szubsztituensek növelik az elektronsûrûséget a karbonil H-atomon, stabilizálják a poláros átmeneti állapotot, és így növelik a reakció végbemenetelének valószínûségét. A halogénszubsztituensek viszont ellenkezõ hatást váltanak ki.
A Br-atom és az OH-gyök egyaránt elektrofil reaktánsok, gázfázisú elemi reakcióik nagyfokú hasonlóságot mutatnak. Barnes és munkatársai [11] a Br- és OH-reakciók sebességi együtthatóinak logaritmusai között két lineáris kapcsolatot állapítottak meg, megfelelõen annak, hogy a reakciók addíciós úton vagy direkt hidrogénlehasítással mennek végbe. A közölt korrelációs egyenesek és saját eredményeim alapján megállapítottam, hogy a brómatom reakciója neopentánnal, bróm-metánnal és triklór-acetaldehiddel nagy valószínûséggel direkt hidrogénlehasítási mechanizmus szerint játszódik le.
Ezúton szeretném megköszönni témavezetõm Dr. Dobe Sándor áldozatkész segítségét, amely végigkíserte munkámat. Köszönettel tartozom Dr. Bérces Tibor akadémikus osztályvezetõnek, hogy lehetõve tette, és támogatta munkám elvégzését az MTA KKKI Reakciókinetika Osztályán.
Kinetic Studies of Selected Br-atom Reactions
Ph. D. Thesis
Eötvös Loránd University, Budapest*
1999
I. Introduction
Gas phase elementary reactions of Br-atoms play significant roles in numerous complex reaction systems of both practical and academic interest. For instance the classical studies of the bromine-hydrogen reaction have contributed to the foundation of reaction kinetics. Moreover, the kinetic investigations of the reactions between bromine atoms and organic compounds have been, and continue to be one of the most important ways of determining thermochemical data for free radicals.
In the last few decades the role that halogen atoms play in atmospheric chemistry has been recognized, which has given a fresh impulse for the research of bromine atom reaction kinetics. In the stratosphere, chlorine and bromine containing chemicals are photolyzed producing halogen atoms, which deplete the ozone layer through catalytic reaction cycles. Resent results show that bromine atoms are even more powerful than chlorine in destroying ozone. The knowledge of accurate kinetic and thermochemical parameters for the elementary reaction steps is indispensable to the exact description of the above mentioned complex reaction systems.
The objectives of the kinetic investigations performed were the following: (i) to determine new rate coefficients and kinetic parameters (preexponential factors and activation energies); (ii) to investigate structure-reactivity relationships; (iii) to determine enthalpy of formation values for free radicals by using the kinetic method; and (iv) to compare results obtained by different experimental techniques.
The following elementary reactions were studied:
Besides to being of interest for basic research, some of the reactions studied are important also from atmospheric chemistry point of view, while others allowed the determination of the enthalpies of formation for free radicals of combustion and atmospheric chemistry relevance.Br + neo-C5H12 >neo-5H11 + HBr ( 1)
Br + C2H6 >
2H5 + HBr ( 2)
Br + CH3Br >
H2Br + HBr ( 3)
Br + CH2BrCl >
HBrCl + HBr ( 4)
Br + CCl3CHO > CCl3
O + HBr ( 5)
Br + C2H5CHO > C2H5
O + HBr ( 6)
II. Experimental
Kinetic investigations were carried out by two different experimental techniques. In most cases, the laser flash photolysis technique was applied which was connected with resonance fluorescence detection of the Br-atoms (LP / RF technique). For comparison and the extension of the temperature range of the experiments, the more conventional relative-rate method was also employed (RR technique).
The laser flash photolysis / resonance fluorescence technique is based on the direct measurement of the Br-atom concentration as a function of reaction time. Br-atoms were generated from a suitable precursor (CF2Br2 or CH3Br) by KrF (248 nm) excimer laser pulses. Bromine atoms were excited by a Br resonance lamp powered by a microwave generator. The induced resonance light was detected by a solar blind photomultiplier. From the temporal profile of the RF signal (which is proportional to the Br-atom concentration), kb, the overall rate coefficient was obtained under pseudo-first-order conditions in great excess of the RH reactant, ([RH]>>>[Br]0):
![]()
Relative-rate coefficients, kx / kv, can be determined by the relative-rate (RR) method. In this case, the rate of the Br-atom reaction under study (x) is compared to that of the reference reaction (v) by measuring the rate of formation of the products, R1Br and R2Br.
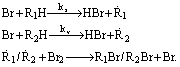
The relative-rate coefficient, kx /
kv,
can be resolved if kv is known. RR experiments were performed
in a quartz reactor by photolyzing mixtures of reactants (Br2 /
R1H / R2H / He) by a high-pressure mercury lamp.
The reaction products were analyzed at different reaction times by sampling
gas chromatography.
III. Results
The kinetic and thermochemical results obtained in the current work have been summarized in Table I.
1. Br + neopentane (1 ) reaction
Kinetic studies of gas phase bromination of hydrocarbons have been the subject of reaction kinetics for a long time. Nevertheless, kinetic parameters for the reaction of Br-atoms with neopentane have not yet been determined by direct experimental techniques.
Kinetics of reaction (1) were investigated by both (LP / RF and RR) experimental methods.
The results of the LP / RF experiments in the 688-775 K temperature range can be described well by the following Arrhenius expression (errors are 1 standard deviations) [3]:
k1 = (6.89 ± 2.27)·1014 exp[- (57.61 ± 2.05) kJ mol-1/ RT] cm3 mol-1s-1.
In the RR measurements the reaction Br + C2H6 (2) served as a reference. The experiments were carried out at 298 K and 1000 mbar total pressure of helium. The following rate coefficient ratio was obtained [2]:
k1 / k2 = 0.83 ± 0.21.
To date no other direct kinetic studies are known for the Br + neopentane (1) reaction. The only other relative-rate determination of the kinetic parameters for this reaction has been published by Fettis and co-workers [5], whose results are in satisfactory agreement with those of the current work.
The relative-rate coefficient obtained from the RR studies was put on an absolute scale by taking a k2 value from the literature [6]. In this way:
k1 (298 K) = (5.3 ± 5.2) · 104 cm3 mol-1 s-1
was obtained. This is in very good agreement with the rate coefficient value obtained from the direct LP / RF experiments in particular if one takes into account the uncertainties that arise from the extrapolation to room temperature:
k1 (298 K) = (5.6 ± 5.0) · 104 cm3 mol-1 s-1.
Table I.
Summary of the kinetic and thermochemical results
| Reaction |
cm3 mol-1 s-1 |
cm3 mol-1 s-1 |
kJ mol-1 |
|
|
|
|
|
|
38 ± 6 kJ mol-1 |
|
|
|
|
|
0.83 ± 0.21 |
|
|
|
|
|
175.6 ± 1.8 kJ mol-1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k5(450K)=(9.80±1.01)· 109
cm3 mol-1s-1 |
The two k1values determined by entirely different experimental methods and their good agreement shows the reliability of the results. As the final result of the LP / RF and RR experimental investigations, the following rate coefficient expression is recommended in the 298-775 K temperature range:
k1 = (8.5 ± 1.8)· 109·T 1.5 exp[- (49.0 ± 1.3) kJ mol-1/ RT] cm3 mol-1 s-1.
2. Br + bromomethane (3) reaction
Among bromine containing chemicals bromomethane occurs in the highest concentration in the atmosphere. Revealing of the kinetic behavior for this compound is of vital importance for the bromine chemistry of the atmosphere, and the problem of the depletion of the Earths protecting ozone layer. Kinetic studies of the Br + CH3Br (3) reaction were performed by using both (LP / RF and RR) experimental techniques.
The LP / RF experiments were carried out at 160-180 mbar total pressure (in helium). Br-atoms were produced directly by the laser flash photolysis of bromomethane. The temperature dependence of the rate coefficient was found to obey the Arrhenius law in the 720-777 K temperature range:
k3 = (9.6 ± 1.3)· 1013 exp[- (68.6 ± 1.7) kJ mol-1/ RT] cm3 mol-1 s-1.
The preexponential factor is in accordance with the A-factors known for Br + hydrocarbon reactions which were determined by direct kinetic methods. The activation energy is about 8 kJ / mol lower than that of the Br + CH4 reaction.
The k3 expression above appears to be the first kinetic result for the Br + CH3Br (3) reaction determined by a direct kinetic technique. Besides this, only rate coefficients and rate coefficient ratios derived from conventional thermal and photobromination studies are available from the literature. Amphlett and Whittle [7] have published a critical review and recommended an expression for k3, which is in good agreement with our determination.
The RR kinetic method was applied for the study of the Br + CH3Br (3) / Br + CH2BrCl (4) reaction system. Relative-rate coefficients were determined by gas chromatographic analyses of the reaction products. The experiments were carried out at 100-400 mbar total pressure. The following rate coefficient expression was derived from the measurements in the 353-410 K temperature range:
k3 / k4 =(1.63 ± 0.12) exp [(15.6 ± 0.4) kJ mol-1/ RT]
The k3 / k4 ratio increases with increasing temperature indicating that the activation energy for reaction (3) is greater than that for reaction (4). No kinetic data are available for the Br + CH2BrCl (4) reaction in the literature. LP / RF experiments have been launched for the study of reaction (4) but these have not been finished until the publication of the thesis. An approximate expression for k4 can be given, however, by combining k3 / k4 and k3:
k4 ~5.9· 1013 exp[- (53.0) kJ mol-1/ RT ] cm3 mol-1 s-1 .
3. Reaction of Br-atom with trichloro-ethanal and propanal
Trichloro-ethanal and propanal are reaction intermediates in the atmospheric degradation of propane and methyl-chloroform, respectively. Their atmospheric reactions with bromine atoms can be more significant than they were presumed earlier. Despite this importance, very few experimental studies have been carried out so far.
Rate coefficients for the reaction of Br + trichloro-ethanal (5) were determined at 298 and 450 K temperatures and for the reaction of Br + propanal (6) at room temperature by the application of the LP / RF technique.
In the room temperature investigations the rate coefficients for the Br + trichloro-ethanal (5) reaction were overestimated as a consequence of the photolysis of the aldehyde that occurred to a disturbing extent. This problem was negligible in the experiments, which were carried out at 450 K because of the significantly lower concentration of the CCl3CHO reactant. Thus, the following rate coefficient was determined [1]:
k5(450 K) = (9.80 ± 1.01) · 109cm3 mol-1s-1.
k5(298 K) ![]() 1 · 109cm3 mol-1s-1.
1 · 109cm3 mol-1s-1.
The LP / RF kinetic studies for the Br + propanal (6) reaction resulted in the following room temperature rate coefficient value [1]:
k6(298 K)= (3.90 ± 0.40) ·1012 cm3 mol-1s-1.
This proposed value is in good agreement with that obtained from fast flow kinetic experiments by colleagues in our laboratory [1].
On the basis of the results it can be stated that Br-atoms react with
suprisingly large rate coefficients with alkyl aldehydes. On the other
hand, the rate coefficient for the reaction with CCl3CHO is
smaller by several orders of magnitude. The large rate coefficient for
reaction (6) means that this reaction can be of comparable importance with
the OH radical reaction in the atmosphere. Under special conditions this
can be the most important initial step for the atmospheric photooxidation
of propanal.
4. The enthalpy of formation for the neopentyl and bromomethyl radical
eopentyl radical can be regarded as a prototype for large primary alkyl
radicals. Bromomethyl radical is produced in the first step of the atmospheric
degradation of methyl bromide, which reacts further in several elementary
steps; therefore, ![]() H2Br
radical plays a central role in the bromine chemistry of the atmosphere.
H2Br
radical plays a central role in the bromine chemistry of the atmosphere.
The enthalpy of formation of the neopentyl radical was determined by the second law method. The enthalpy change for the
Br + neo-C5H12reaction was given as the difference of the activation energies for the forward and reverse reactions. The reaction free enthalpy change was calculated from the equilibrium constant, K = k1 / k-1. The standard molar enthalpy of formation for the neopentyl radical was determined with the knowledge of the thermochemical data for the other reactants.neo-
5H11 + HBr
The derivation of the enthalpy of formation requires the kinetic parameters
for the reverse neo-![]() 5H11
+ HBr (- 1) reaction as well. These are not available from the literature,
therefore they were estimated. The estimation was based on the kinetic
parameters for the analogous
5H11
+ HBr (- 1) reaction as well. These are not available from the literature,
therefore they were estimated. The estimation was based on the kinetic
parameters for the analogous ![]() 2H5
+
HBr (- 2) reaction. Since there are significantly different kinetic data
for the reaction of the ethyl radical with HBr reported in the literature,
the estimations were made with all of the data available.
2H5
+
HBr (- 2) reaction. Since there are significantly different kinetic data
for the reaction of the ethyl radical with HBr reported in the literature,
the estimations were made with all of the data available.
he average of the results obtained in this way from the calculations are proposed as the enthalpy of formation for the neopentyl radical:
DfHo 298
(neo-![]() 5H11)
= 38 ± 6 kJ mol-1.
5H11)
= 38 ± 6 kJ mol-1.
This is in good agreement with the value accepted in the literature
[5], but we could give our result only with large error limits. After having
determined DfHo 298
(neo-![]() 5H11)
the C-H bond dissociation enthalpy can be given in the neopentane molecule:
5H11)
the C-H bond dissociation enthalpy can be given in the neopentane molecule:
DHo ((CH3)3(C)H2C-H) = 425 ± 6 kJ mol-1.
The enthalpy of formation for the bromomethyl radical was also determined by the second law method.
The kinetic parameters for the reverse (- 3) reaction were determined by J. A. Seetula in a cooperative study with our research group and were applied in the calculations. The standard molar enthalpy of formation for theBr + CH3BrH2Br + HBr
D fHo 298(![]() H2Br)
= 175.6 ± 1.8 kJ mol-1,
H2Br)
= 175.6 ± 1.8 kJ mol-1,
which corresponds to the following C-H bond dissociation enthalpy in bromomethane
DHo 298 (BrH2C-H) = 433.3 ± 1.9 kJ mol-1.
The D fHo 298(![]() H2Br)
proposed is in very good agreement with the value published in different
thermochemical reviews and handbooks coming from reaction kinetic measurements
[5], and agrees satisfactorily with the enthalpies of formation obtained
from photoionization mass spectrometric studies and ab initio calculations
[10].
H2Br)
proposed is in very good agreement with the value published in different
thermochemical reviews and handbooks coming from reaction kinetic measurements
[5], and agrees satisfactorily with the enthalpies of formation obtained
from photoionization mass spectrometric studies and ab initio calculations
[10].
In the current work, primary C-H bond dissociation enthalpies have been determined. Comparison with literature data shows that the C-H bond strength in neopentane is similar to that in ethane. Thus, the bond dissociation enthalpy for primary C-H bonds in larger alkanes is expected to be approximately equal to this value. On the other hand, Br-atom substitution decreases the C-H bond dissociation enthalpy to a significant extent compared to methane.
DHo 298 (H3C-H) = 439 kJ mol-15. Structure-reactivity relationships for the Br-atom reactions investigated
DHo 298 (BrH2C-H) = 433 kJ mol-1,
DHo 298 ((CH3)H2C-H) = 423 kJ mol-1
DHo ((CH3)3(C)H2C-H) = 425 kJ mol-1.
The thermochemical and kinetic information obtained in the present study and available from the literature were used to examine structure-reactivity relationships. We have concluded that the reactivity of the hydrocarbons toward Br-atom is mainly determined by the thermochemical properties of the reactions. The decisive factor is, however, the polarity of the reaction transition-state in the case of the Br + substituted acetaldehyde reactions. The Evans-Polanyi law was found to be valid for the reaction of Br-atoms with hydrocarbons: the logarithm of the rate coefficients (activation energies) increases linearly with decreasing of the bond dissociation enthalpy of the C-H bond being broken. This linear correlation can be applied for the estimation of unknown rate coefficients if the bond dissociation enthalpy is known.
Bromine atom reacts a few orders of magnitude faster with alkyl substituted aldehydes than with halogen substituted aldehydes. This effect can be explained only to a smaller extent by the enthalpy change of the reactions since the R(CO)-H bond dissociation enthalpies are hardly changed in the reaction series examined. The electrofil property of the Br-atom and the polarity of the reaction transition-state can serve as an explanation for the observed trend in reactivity. The electron-donating alkyl groups increase the electron density on the carbonyl H atom, thus stabilizing the polar transition-state, which leads to increased probability of the reaction. The halogen substituents exert an opposite effect.
Br-atoms and OH radicals are both electrofil reactants and as such, their gas phase elementary reactions show great similarity. Barnes and co-workers [11] have found two linear correlations between the logarithm of the rate coefficients for Br- and OH- reactions corresponding to the mechanism of the reactions, i.e. direct H-abstraction or addition-elimination. From the correlation lines published and the results determined in this study we have concluded that the reactions of Br-atoms with neopentane, bromomethane and trichloro-acetaldehyde proceed probably via direct hydrogen abstraction mechanisms.
Publications
I. Szilágyi, K. Imrik, S. Dóbé, T. Bérces: Kinetics of the Reaction of Bromine Atoms with a Series of Aliphatic Aldehydes at 298 K; Ber. Bunsenges. Phys. Chem. 102, 79-85 (1998).References
K. Imrik, S. Dóbé, T. Bérces: Relative-Rate Kinetic Study of the Reaction of Br-Atom with Neopentane; React. Kinet. Catal. Lett. 65, 271-276 (1998).
K. Imrik, S. Dóbé, T. Bérces: Direct Kinetic Parameters for the Reaction of Bromine Atoms with Neopentane; Int. J. Chem. Kinetics, accepted for publication.
Dóbé S., Szilágyi I., Imrik K., Bérces T.: Kisnyomású halogénlámpák kifejlesztéséhez kapcsolódó reakciókinetikai kutatások; aGE Lighting Tungsram Rt. és az MTA KKKI között létrejött kutatási együttmûködési szerzõdés zárójelentése, 1997. november.
G. C. Fettis, J. H. Knox, A. F. Trotman-Dickenson: J. Chem. Soc. 4177 (1960).
P. W. Seakins, M. J. Pilling, J. T. Niiranen, D. Gutman, L. N. Krasnoperov: J. Phys. Chem. 96, 9847 (1992).
J. C. Amphlett, E. Whittle: Trans. Faraday Soc. 64, 2130 (1968).
J. M. Nicovich, C. J. Schackelford, P. H. Wine: J. Photochem. Photobiol. A. Chem. 51, 141, (1990).
RC Handbook of Chemistry and Physics, 74th Edition, CRC Press, Inc. (1993-1994).
J. L. Holmes, F. P. Lossing: Int. J. Mass. Spectrom. Ion Process. 58, 113, (1984); J. Espinosa-García, S. Dóbé: J. Phys. Chem. A. 103, 6387 (1999).
I. Barnes, V. Bastian, K. H. Becker, R. Overath, Zhu Tong: Int. J. Chem. Kinet. 21, 499 (1989); A. Bierbach, I. Barnes, K. H. Becker: Int. J. Chem. Kinet. 28, 565 (1996).
| Vissza a tartalomjegyzékhez
Back to Contents |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |