Láttuk, hogy a gyertya elégése alkalmával víz keletkezik és e vízbôl hidrogént és oxigént készithetünk. A hidrogén, mint tudjuk, a gyertyából keletkezik, az oxigén pedig a levegôbôl adódik. Joggal kérdezhetitek: – De hát miért nem ég a gyertya a levegôn is éppoly jól, mint az oxigénben? Jól emlékeztek még rá, hogy amikor egy égô gyértyadarabkát oxigénbe helyeztem, egészen máskép égett, sokkal élénkebben, mint az atmoszférikus, azaz szabadlevegôn. Nos miért? Ez a kérdés nagyon fontos reánk nézve, egészen közvetlenül érinti az atmoszférikus levegô természetének a kérdését, és igyekezni fogok minél kimeritôbben és érthetôbben reá válaszolni.
A tárgyaknak az oxigénben való élénkebb
elégése e gáz felismerésére szolgál.
Azt láttátok, hogy ég a gyertya a levegôn és
ég az oxigénben; ugyanezt megfigyelhettétek a foszfornál,
valamint a vasreszeléknél is. Van még néhány
más mód is, és hogy tapasztalataitokat, ismereteiteket
gazdagítsam, néhányat még bemutatok. Ez az
edény telve van oxigénnel. Hogy csakugyan az van benne, azt
természetesen még be kell igazolnom; gyengén pislogó
forgácsot teszek belé és az elôzô alkalommal
szerzett tapasztalatok alapján határozottan elôre megjósolhatjátok
az eredményt – idenézzetek: az élénk elégésbôl
az oxigén jelenléte kétségkívül
kimutatható. Még egy másik és pedig nagyon
különös és hasznos próbája az oxigén
jelenlétének. Két edény van nálam, mindkettô
gázzal van tele; lemez van közöttük, hogy a gázok
ne érintkezhessenek egymással. A lemezt elveszem és
a gázok valósággal egymásba ömlenek. –
Mi történt? – kérdezitek – hisz most nem ég semmi,
mint ahogy a gyertyánál láttuk! – És a két
gáz vegyülésénél mégis az oxigén
jelenlétére kell következtetnetek. Íme szép,
vörösesbarna színû gáz keletkezett ! A kísérletünket
ilymódon közönséges levegôvel is lefolytathatjuk,
ha ezzel a kémlôgázzal keverjük. Az edényben
csupán levegô van, – ugyanaz a levegô, melyben a gyertya
égett – ebben az üvegben pedig kémlôgáz
van, víz fölött összebocsátom a két
anyagot, most lássuk csak, mi lesz; a kísérleti palack
tartalma átömlik abba az edénybe, melyben levegô
van; és ugyanaz a folyamat ismétlôdik meg, mint az
imént az oxigénnél, és ebbôl ugyancsak
arra következtetünk, hogy a levegôben oxigén is
van – ugyanaz az oxigén, melyet már a gyertya elégésénél
keletkezett vízbôl is nyertünk. De hát miért
nem ég a gyertya a levegôn is éppúgy, mint a
oxigénben? Nos, rögtön helyben vagyunk. Két üveg
van elôttem; mindkettô azonos magasságig van megtöltve
légnemû anyaggal. E légnemû anyagok külszínre
megegyeznek, és valóban e pillanatban nem tudom, hogy a két
edény közül melyik tartalmaz oxigént és
melyik levegôt; csak azt tudom, hogy mindkét edényt
gondosan töltöttük meg. Egyébiránt kéznél
van a kémlôgázunk, mindkét edényt kiteszem
a hatásának, hadd lássuk, hogy e gáz megbarnulása
a két edényben mily különbözô módon
megy végbe. Szóval ezt a gázt az egyik edénybe
ömlesztem és lássuk, mi lesz. Nini, rögtön
megbarnult – tehát oxigén van benne! Most vegyük elô
a másik edényt. Nos, az nem barnul meg oly gyorsan és
határozottan, mint az elôbbi edény tartalma. De még
másvalami különös jelenség is mutatkozik.
Ha mindkét gázt vízzel jól kiöblítem,
a víz a
barna gázt magába szívja, feloldja és ha
újra kémlôgázt bocsátok bele, úgy
ismét barna gáz áll elô, majd ismét kiöblítem,
újra feloldódik; mindezt addig folytathatom, míg az
edényben oxigénnek csak nyoma is van.
Ha a kémlõgázt levegôre bocsátom, másmilyen folyamat megy végbe. Itt is barna gáz keletkezik, de ha vizet bocsátok bele, a barna gáz eltûnik és a kémlôgázból addig ereszthetek bele egyre többet, míg az a sajátságos anyag, mely a levegôt és az oxigént barnára festi, nem barnít többé. Hogy lehet ez? Rögtön megtudjátok; mert a levegô az oxigénen felül még oly másvalamit is tartalmaz, mely még utolsónak fennmarad. Egy kevés levegôt az edénybe bocsátok és ha ismét barnulás következik be, abból az következik, hogy a barnító gázból még valami benne volt, ha annak a hiánya e légnemû anyagnak a visszamaradását nem is feltételezte.
Most már könnyebben meg tudjátok érteni, amit mondok. Ha foszfort levegôvel telt edényben elégetünk, úgy ha a foszforból és a levegô oxigénjébôl keletkezõ füst leülepszik, a levegôben meglehetôs mennyiségben, változatlanul fennmarad valami éppúgy, mint ahogy e kémlôgáz is változatlanul visszahagyott valamit; és valóban egy és ugyanaz a gáz az, melyen sem a foszfor, sem a barnító gáz nem bírt kifogni, és ez a valami nem oxigén, de azért mégis alkatrésze a levegônek.
Tehát megtaláltuk a módját annak, hogy a
levegôt arra a két anyagra felbontsuk, amelybôl összetevôdik,
– oxigén, mely a gyertya, foszfor és más anyag elégését
elôsegiti, az egyik, és a másik anyag, mely nem hat
ki az égésre, a nitrogén. Túlnyomó részben
ezt a másik alkatrészt tartalmazza a levegô. Ha megvizsgáljuk,
igazán különös sajátságokat állapíthatunk
meg róla; különös anyag, ámbár talán
ti egyáltalában nem találjátok érdekesnek.
Bizonyos tekintetben ez természetes is, például abban,
hogy nem idéz elô ragyogó égési folyamatot.
Mint a hidrogént és az oxigént, úgy ezt is
mindenekelôtt viaszgyertyával vizsgálom meg. Látjátok,
nem gyullad meg, mint a hidrogén, és a viaszrudat sem hagyja
hogy továbbégjen, mint ahogy az oxigén tette – bármit
csinálok vele, sem ezt, sem amazt nem teszi, nem gyullad meg, sôt
az égô viaszrudat is eloltja; minden lángot kiolt,
bármily anyag ég; egyetlen test sincsen, mely rendes körülmények
között benne égni tudna. A nitrogénnek nincs sem
szaga, sem íze, vízben nem oldódik, tökéletesen
közömbös minden érzékünkkel szemben,
amennyire közömbös csak lehet. Könnyen meglehet, hogy
azt mondjátok: – No hiszen, ez még arra sem érdemes,
hogy figyelmünket ráirányítsuk, mi keresni valója
van a levegôben? – Nono! Vizsgáljuk csak meg közelebbrôl,
vajjon nem sikerül-e róla igazán fontos és szép
megfigyeléseket feljegyezni. Képzeljük csak el,
hogy a levegô csupa oxigénbôl áll, ahelyett hogy
oxigén és nitrogén keveréke lenne, – mi lenne
akkor belôlünk? Tudjátok, hogy az izzó vasdarab
a tiszta oxigénnel teli edényben teljesen elég; nézzétek
meg a tûzhely vasrostélyát a tûzön – mi
lenne belõle, ha a levegô csupán oxigénbôl
állna! A rostély is majdnem oly gyorsan elégne, mint
a szén; mert a rostély vasa is nagy hajlandóságot
mutat az elégésre, azaz jelentôs rokonérzést
mutat az oxigénnel szeyben. A lokomotív tüze olyan lenne,
mint valami faraktár bensejében égô tûz,
ha az atmoszférikus levegô tisztán oxigénbôl
állna. De a nitrogén megfékezi a tüzet, hasznossá
teszi számunkra és azonkívül a többi égési
terméket elvezeti magával, mint ahogy a gyertyánál
láttátok, amint felszáll és szétárasztja
a levegôben messzire és oda vezeti, hol az emberiség
javára más gyönyörû célt szolgál,
a növényvilág fenntartását. Most már
tudjátok, hogy a nitrogén, melyet kezdetben nem tartottatok
érdekesnek, csodálatos szolgálatot tesz.
A nitrogén rendes mivoltában teljesen közömbös elem; még a legerôsebb villamos erô is alig, vagy legfeljebb nagyon kis mértékben kényszeríti arra, hogy a levegô másik alkatrészével, az oxigénnel, vagy más valami anyaggal közvetlen kapcsolatba lépjen; teljesen közömbös és ezért biztosítóanyagnak is nevezhetném.
Mielôtt fejtegetésünkbe mélyebben bocsátkoznánk,
az atmoszférikus levegôrôl egyetmást még
el kell mondanom. Száz rész levegô összetétele
a következô:
| Térfogat | Súlyrész | ||
| Oxigén | 21 | 23 | |
| Nitrogén | 79 | 77 | |
|
|
|
||
| 100 | 100 |
Ez az atmoszférikus levegôben levô oxigén és nitrogén pontosan úgy aránylik egymáshoz, mint ahogy ez az analízis mutatja; úgy találjuk, hogy 5 térfogat atmoszférikus levegô körülbelül 4 térfogat nitrogént és 1 térfogat oxigént tartalmaz. Ily hatalmas tömegû nitrogénre van tehát szükség, hogy az oxigén hatása annyira mérsékelve legyen, hogy a gyertya rendesen égjen és a levegô olyan állapotba jusson, hogy tüdônk nyugodtan és egészségesen lélegezhessék. Mert úgy a lélegzésünk, mint a gyertya égése vagy a kályha fûtése egyaránt a levegô oxigénjének és nitrogénjének helyes vegyi arányától függ.
De még e gázok súlyát is ismertetem veletek.
| 1 köbméter – 1000 liter – nitrogén | súlya | 1252 gramm | |
| 1 köbméter – 1000 liter – oxigén | súlya | 1429 gramm | |
| 1 köbméter – 1000 liter – levegõ | súlya | 1293 gramm |
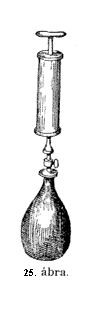 Már
több ízben hallottam és mindig örömmel hallottam
tôletek ezt a kérdést: – Hogyan mérik meg a
gázt? – Megmutatom. Nagyon könnyû és egyszerû.
Itt van ez a mérleg és itt ez a rézpalack; oly vékony
és könnyû, amennyire csak lehet és mégis
erôs és szilárd, amellett a levegôt nem bocsátja
át és a feneke tisztára le van esztergályozva.
Csapja is van, mely könnyen nyílik és könnyen zárul;
most nyitva van, szóval a levegô szabadon betódulhat.
(25. ábra.) Itt van ez a nagyon finom, nagyon érzékeny
mérleg; úgy hiszem, a palack a mostani helyzetében
éppen oly nehéz, mint a másik csészén
levô súly. E szivattyúval levegôt szorítunk
a rézpalackba, még pedig bizonyos térfogat levegôt,
melyre nézve a szivattyú köpûje szolgál
mértékül. No most húsz térfogat levegôt
szorítsunk a palackba. – Így ! – Zárjuk le jól
a csapot és tegyük a palackot a mérlegre. Úgy-e,
hogy süllyed ! Sokkal nehezebb, mint azelôtt. Miért?
Mert levegôt szivattyúztunk bele. Nincs benne más,
Már
több ízben hallottam és mindig örömmel hallottam
tôletek ezt a kérdést: – Hogyan mérik meg a
gázt? – Megmutatom. Nagyon könnyû és egyszerû.
Itt van ez a mérleg és itt ez a rézpalack; oly vékony
és könnyû, amennyire csak lehet és mégis
erôs és szilárd, amellett a levegôt nem bocsátja
át és a feneke tisztára le van esztergályozva.
Csapja is van, mely könnyen nyílik és könnyen zárul;
most nyitva van, szóval a levegô szabadon betódulhat.
(25. ábra.) Itt van ez a nagyon finom, nagyon érzékeny
mérleg; úgy hiszem, a palack a mostani helyzetében
éppen oly nehéz, mint a másik csészén
levô súly. E szivattyúval levegôt szorítunk
a rézpalackba, még pedig bizonyos térfogat levegôt,
melyre nézve a szivattyú köpûje szolgál
mértékül. No most húsz térfogat levegôt
szorítsunk a palackba. – Így ! – Zárjuk le jól
a csapot és tegyük a palackot a mérlegre. Úgy-e,
hogy süllyed ! Sokkal nehezebb, mint azelôtt. Miért?
Mert levegôt szivattyúztunk bele. Nincs benne más,
mint levegô, és a levegô nem is foglal el benne
több helyet, de súlyosabb levegô van e helyen,
mert a levegôt összeszorítottuk.
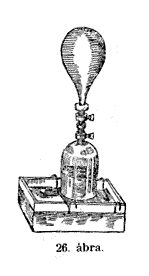 Hogy meglássátok,
mennyi az összepréselt levegô térfogata, itt van
ez a vízzel töltött üveg; nyaka pontosan a rézpalackba
illik és ugyancsak csappal van ellátva. (26. ábra.)
Gondosan egymásba illesztem a két palackot és kinyitom
a csapot, úgyhogy a húsz szivattyúhúzással
összesûrített levegô az üvegpalackba tódul
át és akadálytalanul az eredeti terjedelme szerint
kitágul. Hogy bizonyosak legyünk benne, hogy munkánkat
pontosan végeztük, a rézpalackot ismét mérlegre
helyezzük, és ha a másik csészével – mely
ugyanúgy maradt, mint az elôbb volt – most ismét egyensúlyban
van, akkor kisérletünket jól végeztük. Nos,
a mérleg egyensúlyban van.
Hogy meglássátok,
mennyi az összepréselt levegô térfogata, itt van
ez a vízzel töltött üveg; nyaka pontosan a rézpalackba
illik és ugyancsak csappal van ellátva. (26. ábra.)
Gondosan egymásba illesztem a két palackot és kinyitom
a csapot, úgyhogy a húsz szivattyúhúzással
összesûrített levegô az üvegpalackba tódul
át és akadálytalanul az eredeti terjedelme szerint
kitágul. Hogy bizonyosak legyünk benne, hogy munkánkat
pontosan végeztük, a rézpalackot ismét mérlegre
helyezzük, és ha a másik csészével – mely
ugyanúgy maradt, mint az elôbb volt – most ismét egyensúlyban
van, akkor kisérletünket jól végeztük. Nos,
a mérleg egyensúlyban van.
Eszerint a szivattyúval bepréselt levegô súlyát kipuhatolhatjuk és 1 köbméter levegõ súlyát 1293 grammban állapíthatjuk meg. De az ily kicsinyben végzett kísérlet e tárgy egész jelentôségét nem tárhatja elétek. Igazán csodálatos, mennyivel nyilvánvalóbb ez, ha a kísérletet nagyobb levegõmennyiséggel végzik. Ez a levegômennyiség itten – egy liter – nem egészen 11/2 grammot nyom. Mennyire becsülitek annak a szekrénynek a tartalmát amottan, amelyet egyenesen e célra csináltattam? A benne levô levegô pontosan egy fontot, egy teljes fontot nyom. E terem levegôjének a súlyát is kiszámítottam, el sem hiszitek, hogy menn i, de valóban többet nyom, mint egy tonnát (1000 kilogramm). Lássátok, ily hatalmasan növekednek e számok, és ekkora jelentôsége van az atmoszférikus levegô jelenlétének és a benne levô oxigénnek és nitrogénnek, mibôl viszont annak a haszonnak a nagyságára következtethetünk, amelyet számukra hoz azáltal, hogy ezeket az anyagokat ide-oda, az egyik helyrôl a másikra helyezi és a káros gôzöket oda viszi, ahol hasznot hoznak, ahelyett, hogy ártanának.
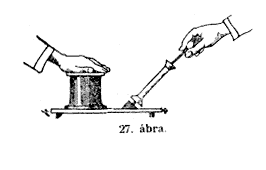 Miután
a levegô súlyára nézve e rövid fejtegetésunket
befejeztük, egyúttal bizonyos következtetéseket
vonjunk le belôle; mert nélkülük nehezen értenétek
meg azokat az újabb következtetéseket, amelyeket még
szinte le kell hogy vonjunk. Emlékeztek még ily hasonló
kísérletre? Nem észleltétek-e még ugyanezt?
Hasonló szivattyút veszek elô, mint amilyent az imént
használtam, hogy levegôt préseljek a rézpalackba,
és oly készüléket kötök vele össze,
melynek nyílását kezemmel befödhetem. A kezünket
a szabadlevegôn oly könnyen ide-oda mozgathatjuk, hogy alig
hisszük, hogy valamit érezünk; és nagyon gyors
mozgás kell ahhoz, hogy a levegô ellenállását
megérezhessük. De ha a kezemet erre a hengerre, a légszivattyú
úgynevezett recipiensére teszem, és a levegôt
kiszivattyúzom – mi töriénik akkor? (27. ábra.)
Kezem egyszerre csak odaszorul a mûszerhez, mintha vasra verték
volna, annyira, hogy magával vonszolhatja az egész légszivattyút,
anélkül hogy megfogtam volna, vagy pedig tartanám. Nézzétek
csak, nem birom tõle a kezemet megszabadítani. Mi az oka
ennek ? Mi szorítja oda a kezem? A súly, a levegõ
nyomásának a súlya. A fölötte levõ
levegô súlya nyomja le oly erôvel a kezemet az üres
térre.
Miután
a levegô súlyára nézve e rövid fejtegetésunket
befejeztük, egyúttal bizonyos következtetéseket
vonjunk le belôle; mert nélkülük nehezen értenétek
meg azokat az újabb következtetéseket, amelyeket még
szinte le kell hogy vonjunk. Emlékeztek még ily hasonló
kísérletre? Nem észleltétek-e még ugyanezt?
Hasonló szivattyút veszek elô, mint amilyent az imént
használtam, hogy levegôt préseljek a rézpalackba,
és oly készüléket kötök vele össze,
melynek nyílását kezemmel befödhetem. A kezünket
a szabadlevegôn oly könnyen ide-oda mozgathatjuk, hogy alig
hisszük, hogy valamit érezünk; és nagyon gyors
mozgás kell ahhoz, hogy a levegô ellenállását
megérezhessük. De ha a kezemet erre a hengerre, a légszivattyú
úgynevezett recipiensére teszem, és a levegôt
kiszivattyúzom – mi töriénik akkor? (27. ábra.)
Kezem egyszerre csak odaszorul a mûszerhez, mintha vasra verték
volna, annyira, hogy magával vonszolhatja az egész légszivattyút,
anélkül hogy megfogtam volna, vagy pedig tartanám. Nézzétek
csak, nem birom tõle a kezemet megszabadítani. Mi az oka
ennek ? Mi szorítja oda a kezem? A súly, a levegõ
nyomásának a súlya. A fölötte levõ
levegô súlya nyomja le oly erôvel a kezemet az üres
térre.
 Még
egy másik kísérletet is csinálok, az még
jobban megvilágítja elôttetek ezt a kérdést.
E henger fölött disznóhólyag van kifeszítve
és rákötve; a hengert összekapcsolom a légszivattyúval
és kiszivattyúzom belõle a levegôt – rögtön
meglátjátok, mi lesz Most a hólyag laposan feszül,
a szivattyút kissé mûködésbe hozom – nini,
hogy süllyed a hólyag, hogy nyomul befelé, egyre mélyebbre
és még mélyebbre benyomódik, míg végül,
nyilván a ránehezedô levegô ereje következtében,
szétpattan. (A hólyag hangos csattanással pattan szét.)
Ezt tisztán és kizárólag a fölötte
levô levegô ránehezedô terhe okozta és
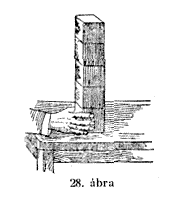
e folyamat nagyon könnyen érthetô. A levegô rétegeit
úgy is elképzelhetjük, hogy azok egymás fölé
vannak halmozva, mint ahogy ez az öt kocka egymás tetejére
van rakva (28. ábra.). Világos, hogy a négy felsõ
kockát az ötödik alsó kocka tartja, és ha
ezt elhúzom, akkor a felsô kockáknak le kell süllyedniök.
Épp így van ez az atmoszférikus levegôvel is.
A felsô levegôrétegeket az alsók tartják,
azokon nyugosznak; és ha ezeket az alsó levegôrétegeket
kiszivattyúzom, ugyanaz a hatás észlelhetô,
mint amit a recipiensre helyezett kezemmel vagy a szétpattant hólyagnál
észlelhettetek és amit most még jobban megfigyelhettek.
Erre az edényre vékony gummilapot feszítettem és
most ki fogom szivattyúzni a levegôt belôle. E gummilapon,
mely az alsó és a felsô levegõrétegek
között válaszfalul szolgál, nagyon jól megfigyelhetitek
a levegô nyomását. Most már az egész
kezem belefér az edénybe, annyira behorpadt a gummilap. Mindez
kizárólag a felsô levegôrétegek hatalmas
nyomása folytán következett be. Mily szépen mutatkoznak
e csodálatos körülmények!
Még
egy másik kísérletet is csinálok, az még
jobban megvilágítja elôttetek ezt a kérdést.
E henger fölött disznóhólyag van kifeszítve
és rákötve; a hengert összekapcsolom a légszivattyúval
és kiszivattyúzom belõle a levegôt – rögtön
meglátjátok, mi lesz Most a hólyag laposan feszül,
a szivattyút kissé mûködésbe hozom – nini,
hogy süllyed a hólyag, hogy nyomul befelé, egyre mélyebbre
és még mélyebbre benyomódik, míg végül,
nyilván a ránehezedô levegô ereje következtében,
szétpattan. (A hólyag hangos csattanással pattan szét.)
Ezt tisztán és kizárólag a fölötte
levô levegô ránehezedô terhe okozta és
e folyamat nagyon könnyen érthetô. A levegô rétegeit
úgy is elképzelhetjük, hogy azok egymás fölé
vannak halmozva, mint ahogy ez az öt kocka egymás tetejére
van rakva (28. ábra.). Világos, hogy a négy felsõ
kockát az ötödik alsó kocka tartja, és ha
ezt elhúzom, akkor a felsô kockáknak le kell süllyedniök.
Épp így van ez az atmoszférikus levegôvel is.
A felsô levegôrétegeket az alsók tartják,
azokon nyugosznak; és ha ezeket az alsó levegôrétegeket
kiszivattyúzom, ugyanaz a hatás észlelhetô,
mint amit a recipiensre helyezett kezemmel vagy a szétpattant hólyagnál
észlelhettetek és amit most még jobban megfigyelhettek.
Erre az edényre vékony gummilapot feszítettem és
most ki fogom szivattyúzni a levegôt belôle. E gummilapon,
mely az alsó és a felsô levegõrétegek
között válaszfalul szolgál, nagyon jól megfigyelhetitek
a levegô nyomását. Most már az egész
kezem belefér az edénybe, annyira behorpadt a gummilap. Mindez
kizárólag a felsô levegôrétegek hatalmas
nyomása folytán következett be. Mily szépen mutatkoznak
e csodálatos körülmények!
Itt van ez a kis mûszer, melyen elôadásom befejezése után kipróbálhatjátok erôtöket, hogy széjjel tudjátok-e húzni? Két üres sárgaréz félgömbbôl áll, a falak pontosan összeillenek, az egyik csôvel van ellátva, amelyen csap van, úgy hogy a levegôt ki lehet szivattyúzni belôle és aztán lezárható. Nini, a két félgömb, most hogy levegô van bennük; egészen könnyen szétválasztható; de ha a levegôt kiszivattyúzzuk, meglássátok, hogy közületek ketten, bárhogy erôlködtök, nem tudjátok széjjelhúzni. A zárt és kiszivattyúzott gömb felületének minden négyzetcentiméterére körülbelül egy kilogramm súlynyomás nehezedik, ugyancsak összeszedhetitek minden erôtöket, ha megkísérlitek, hogy ezt a légnyomást le tudjátok-e gyûrni.
Itt van még ez az apró jószág is, gyerekek szopják, szóval cucli, persze a tudomány számára kissé tökéletesbítve. Oly fiatalemberek, mint mi, joggal nyúlunk néha játékszer után is, hogy kutatásaink eszközévé tegyük; mint ahogy olykor-olykor a tudományból is játékot csinálnak. Szóval itt van ez a cucli, gummiból készült. Ha az asztalra csapom, íme, szilárdan megáll rajta. Miért? Végigcsúsztathatom az asztalon, de ha fel akarom emelni, mintha magával akarná vonszolni az asztalt, könnyûszerrel jobbra-balra tolhatom, de csak ha az asztal szélére, a deszka élére juttatom, csak akkor lehet onnan eltávolítani. E szopókát is a levegô nyomása tartja oly szilárdan.
Van itt több is; vegyetek el kettôt és nyomjátok egymásnak! No lám, mily erôsen egybetapadnak. Egészen jól fel lehet használni arra a célra, amelyre készültek, ugyanis hogy az ablakra, sima falakra erôsítsék és mindenféle apróságot aggassanak rájuk; egész napon át fennmaradnak. Tudom, hogy a gyerekek szívesen fogadják az olyan kísérleteket, amelyeket odahaza könnyen utánozhatnak, ezért még egy kedves dolgot mutatok meg nektek, hogy a légnyomást szemléltessem. Ez a pohár tele van vízzel, és ha azt kérdezem tôletek, vajjon ezt a poharat meg tudjátok-e fordítani, anélkül hogy a víz kiömlene belôle és a kezetekkel sem tartjátok be a pohár száját, és csupán a légnyomás tartja a vizet – meg tudnátok-e ezt csinálni? Vegyetek elô egy borospoharat egészen vagy félig telve vízzel, tegyetek rá egy papírlapot és forgassátok meg óvatosan úgy, ahogy én csinálom, és nézzétek, mi lesz a vízzel és mi a papirossal ? A levegô nem tud benyomulni, mert a víz, a hajcsövesség, azaz a kapilláris vonzóereje folytán a papirost és a pohár peremét köröskörül szorosan összetartja. És a víz nem folyik ki, mert a külsô légnyomás nem engedi kifolyni.
Remélem, hogy ezek után a levegô súlyáról és anyagáról most már helyes fogalmat nyertetek és ha azt mondom nektek, hogy az a szekrény amott egy font levegôt tartalmaz és e szoba levegôjének a súlya több mint egy tonna, akkor megértitek, hogy a levegô súlyos anyag. Még egy másik kísérlettel is bemutatom a levegô ellenállóképességét. A bodzapuskát mindenki ismeri, amelyet a bodzabél kitolása után a belül üres ágból csinálunk, vagy a tollpuskát. A krumpli vagy alma korongjából lúdtollal dugaszt vájunk ki és azt a toll végére tolom: így ni, és ezzel a toll vége szorosan el van zárva; majd egy másik dugaszt vájok ki és betolom a toll belsejébe. Ezzel a tollba szorult levegô teljesen el van dugaszolva, ahogy a célunknak meg is felel. És íme, kiderül, hogy a második dugaszt semmiféle erôvel nem lehet az elsôhöz odatolni; ez tiszta lehetetlenség. Bizonyos fokig a levegôt össze lehet ugyan préselni, de még jóval elôbb, mielôtt a két dugasz érintkeznék egymással, a tollba szorult levegô az elülsô dugaszt nagy durranással kilöki. Ugyanaz a hatás ismétlôdik meg itt is, mint a puskapornál, melynek ereje részben ugyanazokiól a körülményektõl függ. mint amelyek itt elôttünk megnyilatkoztak.
Egy kísérletet néztem nemrég végig; nekem nagyon tetszett és céljainkra rögtön felhasználhatjuk. Hogy az eredményben biztos lehessek, néhány percre el kellett volna hallgatnom, mielôtt a kivitelhez hozzáfogtam volna, mert e kísérletnél nagyon sok függ a tüdôtôl. Arról van szó ugyanis, hogy ezt a tojást lélegzetemmel az egyik tojástartóból a másikba fújjam; nem vagyok egészen bizonyos benne, hogy kísérésletem eredményes lesz-e, mert túlságosan sokat beszéltem, és ha próbálkozásom nem sikerül, az ok nyilvánvaló.
(Az elôadó végigcsinálja a kísérletet és sikerül neki a tojást az egyik pohárból a másikba fújni.)
Látjátok, a levegô a tojás és a pohár fala között lefelé nyomul és a tojásra alulról oly nyomást gyakorol, hogy . azt fel bírja emelni, holott a tojás a levegôhöz viszonyítva nagyon nehéz. Ha ti is meg akarjátok csinálni ezt a kísérletet, jó lesz, ha a tojást keményre fôzitek és akkor aztán nyugodtan megkísérelhetitek az egyik pohárból a másikba fújni; és kellô óvatossággal sikerülni is fog a dolog.
De egyelôre elég ennyit a levegô nyomásáról és súlyáról; még más fontos tulajdonságát is meg kell hogy ismerjük. Az elôbb láttátok, hogy a tollpuskával a második dugaszt 1/2-3/4 hüvelyknyire be tudtam szorítani, mielôtt a külsô dugasz kiröpült volna, szóval a beszorult levegô bizonyos fokig engedett a nyomásnak; azt is láttátok hogy szivattyúval mennyire össze lehet szorítani a rézpalackban. Ez a levegô egyik csodálatos tulajdonságával függ össze: az elaszticitással vagy rugalmassággal. A levegô e tulajdonságát lehetôleg jól szemléletessé teszem elôttetek. Ez a gummihólyag kiválóan alkalmas erre. Áthatolhatatlan, a levegõt nem engedi sem ki-, sem benyomulni, azonban ki bir tágulni és ismét össze tud húzódni, úgy hogy a beléje szorult levegônek minden tekintetben engedelmeskedik és ennélfogva a levegô rugalmasságának fokmérôje lehet. Azt látjátok, hogy a petyhüdt hólyag kevés levegôt tartalmaz. Jól bekötöm, a légszivattyú burája alá helyezem és a burából kiszivattvúzom a levegôt, szóval a burában levô levegônek a hólyagban levõ levegôre gyakorolt nyomását megszüntetem. Lám, hogy tágul a hólyag, egyre jobban és jobban tágul, míg végül is a bura bensejét egészen betölti. És ha az üvegburába a levegôt ismét bebocsátom, íme, a hólyagban levô levegô ismét visszanyeri elôbbi terjedelmét. Ez világosan megmutatja nekünk a levegônek azt a csodálatos tulajdonságát, amelyet rugalmasságnak nevezünk. E tulajdonságánál fogva tud oly nagymértékben összehúzódni és kitágulni; és ez teszi alkalmassá arra a fontos szerepre, amelyet a természet háztartásában betölt.
Ezúttal a tárgykörünk másik és pedig nagyon fontos részéhez értünk. Emlékezzünk csak vissza arra, mit tapasztaltunk az égô gyertyánál? Láttuk, hogy az égésnél különbözô anyagok keletkeztek, korom alakjában szenet nyertünk, azonkívül vizet és még valamit, amit még nem vizsgáltunk meg. A vizet felfogtuk, de a többi égési termék akadálytalanul a levegôbe szállt. Ezeket is meg kell most már vizsgálnunk.
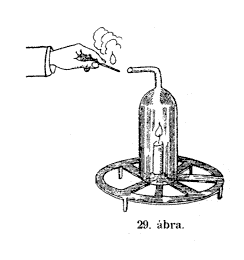 Ez
a szerkezet (29. ábra) e kísérletünknél
jó szolgálatot tesz. A gyertyát ennek a kerek vasállványnak
a közepére tesszük, és föléje helyezzük
ezt az üvegbôl készült kéményt
– így ni! A gyertya szépen továbbég, hisz a
levegô alulról is, meg felülrôl is szabadon átjárja.
Ismét lejátszódik elôttetek az a már
ismert jelenség, hogy az üveg fala átnedvesedik: ez
az a víz, mely a gyertyalángból kifejlôdött
hidrogén és a levegô oxigénjének egyesülésébôl
származott; de odafent még valami más is kiáramlik:
ez nem nedvesség, nem is víz, le nem csapolható és
azonkivül is sok más különös tulajdonsága
van. Az üvegkémény nyílása elé
lángot tartok és íme a kiáramló levegô
majdnem eloltja; és ha teljesen kiteszem az áramlás
hatásának, lám, egészen kialszik. Erre azt
mondjátok: ennek így kell lenni, mert az elégést
elôsegítô levegôbôl csupán a nitrogén
maradt fenn, a nitrogén pedig az égést nem tartja
fenn, tehát az égô forgácsnak el kell aludnia.
Helyes; de hát a nitrogénen kivül nem jelentkezik még
más is? Egy kissé elébe kell vágnom a mondanivalómnak,
azaz a tudásom távolabbi területére kell elkalandoznunk,
hogy e feladatot megoldhassuk és az ilyen gázt, mint ez,
megvizsgálhassuk. Tehát egy üres palackot fordítva
e kémény fölé tartok; a gyertya égési
termékeit felfogom; és azonnal meggyôzôdhetünk
róla, hogy a felfogott légnemû anyagnak nem az az egyedüli
sajátsága, hogy az égésre nagyon kedvezôtlenül
hat, 2 lám, a viaszrudam azonnal elalszik benne – hanem még
más tulajdonságokkal is rendelkezik.
Ez
a szerkezet (29. ábra) e kísérletünknél
jó szolgálatot tesz. A gyertyát ennek a kerek vasállványnak
a közepére tesszük, és föléje helyezzük
ezt az üvegbôl készült kéményt
– így ni! A gyertya szépen továbbég, hisz a
levegô alulról is, meg felülrôl is szabadon átjárja.
Ismét lejátszódik elôttetek az a már
ismert jelenség, hogy az üveg fala átnedvesedik: ez
az a víz, mely a gyertyalángból kifejlôdött
hidrogén és a levegô oxigénjének egyesülésébôl
származott; de odafent még valami más is kiáramlik:
ez nem nedvesség, nem is víz, le nem csapolható és
azonkivül is sok más különös tulajdonsága
van. Az üvegkémény nyílása elé
lángot tartok és íme a kiáramló levegô
majdnem eloltja; és ha teljesen kiteszem az áramlás
hatásának, lám, egészen kialszik. Erre azt
mondjátok: ennek így kell lenni, mert az elégést
elôsegítô levegôbôl csupán a nitrogén
maradt fenn, a nitrogén pedig az égést nem tartja
fenn, tehát az égô forgácsnak el kell aludnia.
Helyes; de hát a nitrogénen kivül nem jelentkezik még
más is? Egy kissé elébe kell vágnom a mondanivalómnak,
azaz a tudásom távolabbi területére kell elkalandoznunk,
hogy e feladatot megoldhassuk és az ilyen gázt, mint ez,
megvizsgálhassuk. Tehát egy üres palackot fordítva
e kémény fölé tartok; a gyertya égési
termékeit felfogom; és azonnal meggyôzôdhetünk
róla, hogy a felfogott légnemû anyagnak nem az az egyedüli
sajátsága, hogy az égésre nagyon kedvezôtlenül
hat, 2 lám, a viaszrudam azonnal elalszik benne – hanem még
más tulajdonságokkal is rendelkezik.
Egy kevés oltatlan mészre közönséges vizet öntök, néhányszor felrázom, a keveréket e tölcsérben levô szûrôpapírra helyezem és néhány pillanat alatt, mint látjátok, az alatta levô palackba tiszta viz csurog. Amott egy egész üvegre való van e vízbôl, – meszes vízbôl – amit éppen oly jól használhatnék, de hisz tudjátok, kísérleteimet nagy elôszeretettel oly dolgokon próbálom ki, amelyek a szemeitek láttára jöttek létre. E szép tiszta meszes vízbôl egy keveset beléöntök ebbe az üvegbe, melybe a gyertya levegôjét felfogtam, és most lássuk csak, micsoda változás következik be! Íme a meszes víz egészen tejszerû folyadékká vált. Vigyázzatok csak, megmutatom azt is, hogy a puszta levegôvel ilyesmi nem esik meg. Itt van ez az üveg, mint látjátok, nincs benne egyéb, mint levegô; kevés meszes vizet öntök bele és jól felrázom, egészen tiszta marad; sem a levegô oxigénje, sem a nitrogénje, sem más, ami a levegôben lehet, nem hoz létre ily változást a meszes vízben. Ugyanezt az üveget ugyanezzel a meszes vízzel úgy az üvegkémény felé tartom, hogy a gyertya égési gázai belétóduljanak és a meszes vízzel érintkezésbe jöhessenek, – nos, egykettôre tejszerû folyadékká vált. E fehér anyag nem képzôdhetett egyébbôl, mint a meszes vízben felhasznált mészbôl és abból a másvalamibál, ami a gyertyából származott – abból a másik égési termékbôl, melynek mivoltát épp most akarjuk kifürkészni és amirôl ma beszélni akarok veletek. Eddig csupán a meszes vízre gyakorolt hatásából következtetünk a jelenlétére, mely egészen új elôttünk és amelyet, mint láttuk, sem az oxigén, sem a nitrogén, a víz sem idézhetett szerintünk elô. E fehér por, mely a meszes vízbôl és a gyertya égésénél keletkezô gázokból állt elô látszólag, teljesen a kréta tulajdonságaival rendelkezik és ha közelebbrôl megvizsgáljuk, úgy találjuk, hogy csakugyan pontosan az az anyag, mint a kréta. És így, miközben egy oly mindennapos folyamatot, mint a gyertya égése, igyekeztünk megismerni, egészen váratlanul tanúi lettünk annak, hogy miképpen keletkezik a kréta és kísérletünknél észlelhetô körülmények gondos megfigyelésével a keletkezésének feltételeit is megismertük. Ha a krétát (legjobb, ha kissé nedves) erôsen felhevítjük, égetett mész válik belõle; tehát annak a másik alkotórésznek, melyet a mészen kívül tartalmaz, el kellett közben illannia; és valóban így is van. A kréta vagy a mész elégése alkalmával ugyanaz a gáz illan el, amely a gyertya égésénél keletkezik, és a mésszel való egyesülése alkalmával ismét csak krétát ad.
Hogy ezt a gázt, melyet szénsavnak* nevezünk,
nagyobb mennyiségben elôállíthassuk és
tulajdonságait közelebbrôl megismerjük, kényelmesebb
eljáráshoz kell folyamodnunk. A szénsav nagy
mennyiségben fordul elô a természetben és
sok esetben ott, hol a legkevésbé keresnôk. Minden
mészkô nagyrészben abból a gázból
áll, mely itt a gyertyából kifejlôdôtt;
valamennyi mész- és krétahegy, kagylóhéj,
korall stb. nagy mennyiségben szénsavat tartalmaz.
E különös légnemû anyagot oly szilárd
kõzetben, mint a márványban vagy a mészben
megszilárdulva találjuk, légnemû mivoltát
megváltoztatva teljesen a szilárd testek sajátságait
vette fel – ezért
Black el is nevezte fix levegônek, azaz szilárd
levegônek
A márványból könnyûszerrel fejleszthetünk szénsavat. Ebben az edényben kevés sósav van és felette, mint a viaszgyertya is igazolja, nincs más, csak szabad levegô; íme, a gyertyával egészen a fenekére megyek, – az edényben a sósavon kivül nincs más, csak levegô. E márványból, amely a legszebb, legfinomabb fajtából való, néhány darabkát az edénybe dobok – azonnal látható módon erôsen forrni kezd. De nem vízgôz száll fel, hanem gáz, mely az odahelyezett viaszgyertyára, mint látjátok, teljesen ugyanazt a hatást gyakorolja, mint az elôbb az üvegkéménybôl kiáramló levegô gyakorolt a gyertyára – a lángot eloltja, és itt is pontosan ugyanaz a jelenség játszódott le, ugyanannak a gáznak, a szénsavnak hatása következtében. Ilymódon nagy mennyiségben állithatunk elô szénsavat; íme, az edény egészen színültig megtelt vele. (Ezt úgy igazolja be, hogy az égõ forgács elalszik, mihelyt ez edénybe mártják.)
De nemcsak a márvány tartalmaz ily gázt. Ebbe az edénybe egy kevés iszapolt krétát is tettem – olyan krétát, melyet vízzel való mosás folytán a durva részektôl már megszabadítottak, miáltal mennyezetmunkákra és hasonlókra alkalmasabbá tették. A nagyobbik edényben iszapolt kréta meg víz van, ebben pedig tömény kénsav, mely jelen kísérletünk véghezvitelére nagyon alkalmas; ugyanis csupán a kénsavval alkot a mész a szénsav felszabadulásakor ismét oldhatatlan testet, míg a sósav, mint az elôbb történt, oldható anyagot ad, mely a vizet egyáltalában nem teszi zavarossá. Mindjárt meglátjátok, hogy miért készítem elô ilymódon a kísérleteimet – azért, hogy kicsiben ti is megcsinálhassátok ugyanazt, amit én nagy arányban mutatok be nektek. Ugyanaz a folyamat játszódik le most is elôttünk, mint amelyet a sósavnak a márványra gyakorolt hatásánál megfigyelhettünk; e nagy edényben szénsavat fejlesztek, és az minden kémlôszerrel szemben teljesen ugyanannak a gáznak mutatkozik, mint amelyet a gyertyának a szabad levegôn való elégésénél nyertünk. Bármennyire különbözôknek látszanak az elôállítás módszerei – az eredmény tökéletesen ugyanaz, mindkét alkalommal ugyanazt a szénsavat kaptuk.
Közben térjünk át e gázzal való további kísérletünkre, hogy természetét közelebbrôl megismerjük. (Egyes hengereket, melyekben víz is volt, közben megtöltöttek ilyen gázzal.) Ez az edény telve van szénsavval és mint az elôbb megvizsgált gáznemû anyagokkal megtettük, mindenekelôtt megpróbáljuk, hogyan viselkedik az égéssel szemben. Azt máris látjátok, hogy nem gyúlékony és az égést sem táplálja. (A gázba dugott égô viaszrúd kialszik és a gáz sem gyullad meg.) A víz sem nagyon oldhatja, mert a víz felett egészen könnyen felfoghattuk. Azt már korábban láttuk, hogyan hat a meszes vízre, hogyan alkot krétát azzal együtt; és e kréta egyik alkatrészévé válik, melyet éppen a szénsavból és mészbôl való összetételénél fogva – éppúgy mint a márványt, mészkövet, korallt stb. – szénsavas mésznek is neveznek.
Mindenekelôtt azonban meg akarom mutatni nektek, hogy kismértékben mégis oldódik a vizben, és e tekintetben tehát az oxigéntôl és hidrogéntôl különbözik. E készülék segítségével meg lehet csinálni az oldási mûveletet. A készülék alján márvány meg sav van, felsô részén hideg víz, és mint látjátok, úgy vannak összekötve, hogy a kifejlôdött gáz az egyikbôl a másikba szállhat; mûködésbe hozom e készüléket és a gáz bugyborékolva azonnal átszáll a vizen, és ez így megy egy darabig; nézzük csak, hogy a víz feloldott-e belôle valamit. Egy kevés vizet kimer1tek belôle és megízlelem – savanykás íze van, szénsavval van telítve; de ti tudjátok, hogy kell a szénsav jelenlétét vegyészeti módszerrel megállapítani, tudjátok, hogy a meszes vízzel biztosan fel lehet ismerni a szénsavat – valamit hozzáteszek, és íme azonnal zavaros és fehér lesz.
Még azt is megjegyzem a szénsavról, hogy nehéz
gáz, nehezebb, mint az atmoszférikus levegô. Összehasonlítás
végett felírom ide mindazoknak a gázoknak a súlyát,
amelyeket eddig megvizsgáltunk:
| Egy köbméter hidrogén | súlya | 90 gramm. | |
| Egy köbméter oxigén | súlya | 1429 gramm. | |
| Egy köbméter nitrogén | súlya | 1252 gramm. | |
| Egy köbméter levegõ | súlya | 1293 gramm. | |
| Egy köbméter szénsav | súlya | 1977 gramm. |
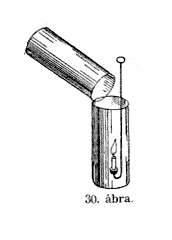 Szóval
egy köbméter szénsav súlya majdnem két
kilogramm. A gáz e súlyos voltát számos kísérlettel
lehet szemléletessé tenni. Ezt az üveget elôveszem
(30. ábra), nincs benne más, mint levegô és
megkísérlem a másik üvegbôl, melyben szénsav
van, egy keveset átönteni; kíváncsi vagyok, vajjon
átömlött-e valami vagy sem. Puszta látásra
ezt nem lehet észrevenni, de a viaszrúd égésével
igen. No tessék, a láng kialudt, mihelyt a gázt az
alacsonyabb edénybe átöntöttem. Még világosabban
kimutathatom ismét a szénsav jelenlétét a meszes
vízre gyakorolt hatásával, mint ezt már többször
végignéztétek. No most ezt a kis vedret belémerítem
a mi szénsav-kútunkba – sajnos, csakugyan nagyon sok valóságos
szénsavas kútunk van – és ha szénsav van benne,
akkor éppúgy meg kell hogy teljék a vödrünk,
mintha vízbe merítettem volna; felhúzzuk, viaszrúddal
megvizsgáljuk a tartalmát, és íme – teli van
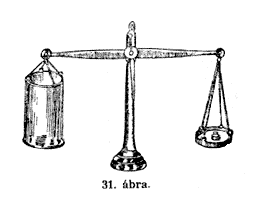
szénsavval. Még feltûnôbben mutatja a szénsav
súlyát a mérlegen végzett kísérletünk
(31. ábra.) A mérleg egyik csészéjére
üvegedényt helyeztem, a másik csészére
az egyensúlyozás végett súlyt raktam. E szénsavval
teli üveg tartalmát átöntöm a mérlegen
levô edénybe, melyben eddig csupán szabadlevegô
volt, és íme, a mérleg azonnal megbillen és
az a fele, melyen az edény van, süllyedni kezd. Nem mulasztom
el most sem az égô viaszrúddal való vizsgálatot,
– íme, látjátok, hogy a mérlegen levô
edényben nem ég tovább, tehát tudjuk, hogy
csakugyan szénsav van benne.
Szóval
egy köbméter szénsav súlya majdnem két
kilogramm. A gáz e súlyos voltát számos kísérlettel
lehet szemléletessé tenni. Ezt az üveget elôveszem
(30. ábra), nincs benne más, mint levegô és
megkísérlem a másik üvegbôl, melyben szénsav
van, egy keveset átönteni; kíváncsi vagyok, vajjon
átömlött-e valami vagy sem. Puszta látásra
ezt nem lehet észrevenni, de a viaszrúd égésével
igen. No tessék, a láng kialudt, mihelyt a gázt az
alacsonyabb edénybe átöntöttem. Még világosabban
kimutathatom ismét a szénsav jelenlétét a meszes
vízre gyakorolt hatásával, mint ezt már többször
végignéztétek. No most ezt a kis vedret belémerítem
a mi szénsav-kútunkba – sajnos, csakugyan nagyon sok valóságos
szénsavas kútunk van – és ha szénsav van benne,
akkor éppúgy meg kell hogy teljék a vödrünk,
mintha vízbe merítettem volna; felhúzzuk, viaszrúddal
megvizsgáljuk a tartalmát, és íme – teli van
szénsavval. Még feltûnôbben mutatja a szénsav
súlyát a mérlegen végzett kísérletünk
(31. ábra.) A mérleg egyik csészéjére
üvegedényt helyeztem, a másik csészére
az egyensúlyozás végett súlyt raktam. E szénsavval
teli üveg tartalmát átöntöm a mérlegen
levô edénybe, melyben eddig csupán szabadlevegô
volt, és íme, a mérleg azonnal megbillen és
az a fele, melyen az edény van, süllyedni kezd. Nem mulasztom
el most sem az égô viaszrúddal való vizsgálatot,
– íme, látjátok, hogy a mérlegen levô
edényben nem ég tovább, tehát tudjuk, hogy
csakugyan szénsav van benne.
Ha szappanbuborékot fújok, természetesen közönséges
levegôvel, és aztán a szénsavval teli edénybe
lebocsátom, akkor az úszni fog. De elôbb ezt a levegôvel
töltött kicsi gömböcskét veszem elõ.
Belehelyezem e részben szénsavval teli edénybe. Ott
úszík a szénsav tetején és ebbôl
megismerhetjük azt a magasságot, ameddig az edény szénsavval
töltve van. Ha még több szénsavat töltök
bele, a gömb emelkedni fog. Most már majdnem teli van az edény;
lássuk csak, ha szappanbuborékot fúvok reá,
csakugyan úgy úszik-e az is a felszínén. (Az
elõadó szappanbuborékot fúj, a szénsavval
telt edénybe bocsátja és az csakugyan a felszínen
úszik.) Éppúgy mint az imént a gömb, ez
is a felszínen úszik, mert a szénsav nehezebb, mint
a levegô.
Íme, megismerkedtünk a szénsavval; a gyertyából
vagy márványból való képzôdése
tekintetében éppúgy, mint a legfontosabb fizikai tulajdonságai
tekintetében, különösen ami a súlyát
illeti; a legközelebbi összejövetelünk alkalmával
meg akarom nektek mutatni az összetételét, azaz hogy
milyen elemekbôl tevôdik össze.
* Szén-dioxid