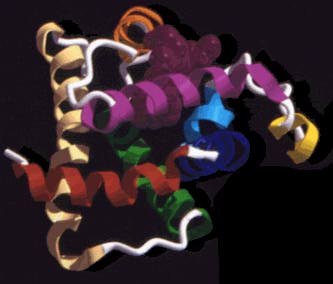
Az apomioglobin – amelynek struktúrája itt látható – alapjában egy mioglobin, egy olyan oxigénszállító fehérje, amely fôleg az izomszövetekben fordul elô. Hiányzik belôle a hem egység, amely a vér vörös színét adja. Az ábrán minden szín egy hélixet jelez a fehérjét kialakító egységek közül, A-tól H-ig – az A a piros, a B a kék, egészen a barnás H-ig.
Brooks apomioglobin-kutatásának a célja az, hogy kiterjessze, illetve kiegészítse az utóbbi idôkben mágneses magrezonanciával (NMR) kapott eredményeket. Az NMR-spektroszkópia leghatékonyabb eszközeivel durva képet kaphatunk arról, hogy különbözô körülmények között a fehérje melyik része van felcsavarodva, illetve kiegyenesedve. Ebben az esetben az NMR-kísérletek azt jelezték, hogy igen savas környezetben az apomioglobin kiegyenesedik – de nem folyamatosan nyújtózik ki, hanem speciális utat követ, azaz – ahogy Brooks mondja – pihenôket tart útközben.
A kísérletek azt jelzik, hogy a fehérjéknek vannak közbülsô stabil állapotai. Az apomioglobin útja pH=2 körül végzôdik, ahol már teljesen kiegyenesedett. De kevésbé savas környezetben, pH=4 körül, megjelenik egy részben becsavarodott, kompakt alakzat, amit Brooks "olvadt gömb"-nek nevezett el. Brooks egyik célja, hogy több információt gyüjtsön errôl és más közbülsô szerkezetekrôl. "A kísérletek alapján a kutatók ezeket a szerkezeteket metastabil vagy átmeneti szerkezeteknek tekintik. De szinte teljesen hiányoznak a szerkezetek részletes modelljei".
Brooks öt különbözô pH-értéken végzett apomioglobin-szimulációkat. A szimulációban szereplô vízmolekulák száma 3800 és 6600 között változott, folyamatosan növekedve, ahogy az apomioglobin egyre jobban kiegyenesedett, azaz egyre több vízmolekula kellett ahhoz, hogy körülvegye. A legkisebb szimulációban 14 000 atomot kellett egyszerre vizsgálni. Minden számítás legalább 1,5 nanoszekundumig követte nyomon a fehérjét, 2 femtoszekundumos (a másodperc trilliomod részének milliomod része) lépésközzel – azaz a végeredmény legalább 75 000 külön kép volt minden szimuláció végén.
Brooks szerint ezeket a szimulációkat nem tudták volna végrehajtani a CRAY C90 "felhasználóbarát" korszaka nélkül. "Nem lettem volna képes ezt a rendszert ennyire aprólékosan kidolgozni egy hagyományos számítógépen – és ebben az esetben a 'hagyományos számítógép'-be beleértendô a normál mûködésû, többfelhasználós C90 is."
Brooks és kollegái jelenleg az adatok eme nagy halmazát elemzik, interaktív grafikát és más eszközöket felhasználva. A munka azonban így is hónapokig, meglehet évekig is eltarthat. A kezdeti eredmények bátorítóak. Mint Brooks nyilatkozta: " A legnyilvánvalóbb eredmény az, hogy nanoszekundumos skálán erôs korreláció van a háromdimenziós alakzatok mozgása és az NMR-eredmények között. Ez volt az elsô mérföldkô, ameddig el akartunk jutni – ez megerôsített abban, hogy a jó úton járunk."