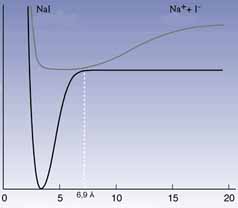
1. ábra. A NaI potenciális energia görbéi
az atommagok közötti távolság
függvényében alap- és gerjesztett állapotban
(alsó, illetve fölsõ görbe)
A vegyészek már régóta törekszenek a kémiai reakciók legapróbb részleteinek tanulmányozására. Az idei kémiai Nobel-díjjal kitüntetett munka módot ad arra, hogy az atomok és molekulák mozgását "lassított felvétellel" kövessük nyomon a kémiai reakciók során.
Ahmed Zewail eljárását a világ leggyorsabb
fényképészeti módszerének nevezhetjük.
A vizsgálatok olyan rövid lézerimpulzusokra épülnek,
amelyek a reakciók lejátszódásának idõtartományába,
a femtoszekundumos tartományba esnek. Egy femtoszekundum 10–15
másodperc – akkora a másodperchez képest, mint a másodperc
a 32 millió évhez képest! A fizikai kémiának
azt a területét, amely a femtoszekundumos folyamatokat vizsgálja,
femtokémiának nevezik.
Száz év kutatás
Mindannyian tudjuk, hogy a kémiai reakciók nagyon eltérõ
sebességgel zajlanak le – gondoljunk csak a rozsdásodó
szögre és robbanó dinamitra. A reakciók többségében
közös, hogy a hõmérséklet emelése
élénkebb mozgásra készteti a molekulákat,
s ezzel megnöveli a folyamatok sebességét. Ezért
már régóta feltételezték, hogy a molekulákat
"aktiválni kell" – "át kell lökni" egy gát fölött.
Ezt a gátat a molekulák atomjait összetartó erõk
szabják meg. Eddig azonban nagyon keveset tudtunk arról,
hogy a molekula hogyan küzdi le a gátat és milyen a
gát tetején, az "átmeneti állapotban".
A svéd fiziko-kémikus, Svante Arrhenius 1889-ben írta le elõször, hogy a kémiai reakciók sebessége hogyan változik a hõmérséklet függvényében. A kémiai sebességi állandóra (k) levezetett képletét
k = A e–Ea/kT
több mint egy évszázada használják a vegyészek (az exponensben k a Boltzmann-állandó, T a hõmérséklet kelvinben, Ea az aktiválási energia: a gát magassága addig a feltételezett állapotig, amelyet Arrhenius "aktivált komplex"-nek nevezett).
Az összefüggés értelmezését az 1930-as években terjeszették ki, amikor Henry Eyring és Michael Polanyi egymástól függetlenül dolgozta ki a mikroszokopikus rendszerek (molekulák) dinamikáján alapuló "átmeneti állapot elmélet"-et, és összefüggést adott meg az exponenciális elõtt álló A tényezõre. Az elmélet egyik feltevése az volt, hogy az átmeneti állapoton nagyon gyorsan, a molekularezgések idejéhez hasonló idõ alatt jutnak át a részecskék. Arról azonban senki sem álmodott, hogy ilyen rövid idõtartamú kísérleteket is végeznek majd.
Pedig Ahmed Zewail éppen ezt teszi, mióta az alacsony
hõmérsékletû antracénmolekulák
vizsgálata során, az 1970-es években, rájött,
hogy a molekulákat arra késztethetjük, hogy egyszerre
rezegjenek. Kísérleteiben kulcsfontosságú szerepet
játszanak a "koherens preparátumok" (lásd késõbb).
A femtokémia kialakulásához az 1980-as évek
végén végzett kísérletsorozat vezetett
el. Zewail eljárásával "pillanatfelvételek"
készíthetõk az átmeneti állapotba került
molekulákról. A "fényképezõgép"
az új lézertechnológián, a néhány
tíz femtoszekundumos fényvillanásokon alapszik. A
molekulákat alkotó atomok egyetlen rezgése 10–100
fs-ig tart. A femtoszekundumos spektroszkópia alkalmazásával
megérthetõ és megjósolható, hogy mi
történik valójában a kémiai reakciók
során.
Egyre rövidebb idõtartamok felé
Fénnyel már korábban is követtek kémiai
folyamatokat: egy spektrofotméterrel és egy órával
mérhetõ a színes anyagok átalakulási
sebessége. Két angol vegyész, Hartridge és
Roughton, 1923-ban két különálló csõben
beérkezõ oldatot egyesített, és a keveréket
egy üvegcsövön vezette el. A keverési ponttól
mért különbözõ távolságokban
figyelték a csövet, és így a reakciót
ezred másodperces részletekig követhették nyomon.
Két 1967. évi Nobel-díjas, Ronald Norrish és George Porter, a villanófény-fotolízissel már milliszekundumos–mikroszekundumos élettartamú molekulákat is tanulmányozott. A Nobel-díjat egy német tudóssal, Manfred Eigennel osztották meg, aki hasonló idõfelbontást ért el úgy, hogy az oldatot nyomás-, áram- vagy hõimpulzusnak tette ki. Ismét néhány milliószoros javulást értek el a felbontásban, amikor molekulák vákuumban zajló ütközéseit vizsgálták. Ezért a munkáért Dudley Herschbach, Yuan Lee és John Polanyi kapott Nobel-díjat 1986-ban.
Mit láttak a vegyészek az idõfelbontás növekedése
nyomán? Az elsõ siker az intermedierek, az anyagok átalakulása
során kialakuló "közbülsõ" termékek
felfedezése volt. Eleinte csak viszonylag stabil intermediereket
észleltek, de ahogy javult az idõfelbontás, egyre
újabb szemeket ismertek fel a reakcióláncban: egyre
rövidebb élettartamú intermediereket is kimutattak,
s egyre jobban látták a reakció lefolyását,
mechanizmusát. A femtoszekundumos spektroszkópiával
már "lassított felvételen" követhetik nyomon
az átameneti állapotot.
A femtokémia a gyakorlatban
A "molekulamozihoz" Zewail vákuumkamrában keveri össze
a molekulasugár formájában beérkezõ
reaktánsokat. Ezután egy ultragyors lézerrel, amely
néhány tíz femtoszekudumos impulzusokat bocsát
ki, két impulzust ad a molekulákra. Az elsõ, nagy
energiájú impulzus a molekulákat nagyobb energiájú
állapotba gerjeszti, és elindítja a reakciót.
A második impulzus gyengébb; hullámhosszát
úgy választják ki, hogy az eredeti molekulát
vagy az átalakult változatot érzékelhessék.
Ez az impulzus megadott intervallumokban érkezik a reakció
elindulása után – így térképezhetõ
fel, hogy a különbözõ részecskék mennyi
idõ alatt jelennek meg vagy tûnnek el. A molekulákat,
a kialakuló képzõdményeket az ujjlenyomatként
szolgáló spektrumok alapján azonosítják.
Az impulzusok közötti idõtartamot a második impulzus
késleltetésével változtatják: tükrökkel
kerülõútra kényszerítik. A kerülõ
azonban rövid, hiszen a fény 100 fs alatt 0,03 mm-t tesz meg.
A folyamatok jobb megismerése érdekében az ujjlenyomatokat
és az idõbeli változást kvantumkémiai
számításokon alapuló szimulációkkal
vetik össze.
Az elsõ, 1987-es kísérletsorozatban Zewail a jód-cianid bomlási reakcióját (ICN —> I + CN) tanulmányozta. Munkatársaival együtt sikerült megfigyelnie az I–C kötés 200 fs alatti bomlását.
Egy másik fontos kísérletben a nátrium-jodid bomlását (Na+I– —>Na+ I) követték nyomon. A gerjesztõ lézerimpulzus a Na+I– ionpárt, amelyben az atommagok közötti egyensúlyi távolság 2,8 Å (1. ábra), a gerjesztett [Na-I]* állapotba viszi. A molekula e mellett a rövid kötéstávolság mellett kovalens jelleget ölt. Tulajdonságai azonban megváltoznak rezgés közben: amikor a Na és a I atomok a "külsõ" fordulóponton vannak, egymástól 10–15 Å-re, az elektronszerkezet ionons [Na+...I–]*. A rezgés kritikus ponthoz érkezik, amikor a távolság 6,9 Å, mert ekkor a gerjesztett állapot (1. ábra, fölsõ görbe) és az alapállapot (alsó görbe) nagyon közel van egymáshoz: a gerjesztett [Na-I]* molekula visszaeshet az alapállapotba, de nátrium- és jódatomokra is elbomolhat.

1. ábra. A NaI potenciális energia görbéi
az atommagok közötti távolság
függvényében alap- és gerjesztett állapotban
(alsó, illetve fölsõ görbe)
Zewail és munkatársai azt tapasztalták, hogy az aktivált komplex ide-oda billegett a kovalens és az ionos szerkezet között, és ezeknek az oszcillációknak az ütemében szabad "nátriumatom-csomagok" keletkeztek. Ennek az a magyarázata, hogy a gerjesztõ impulzus számos olyan gerjesztett molekulát keltett, amely 2,8 Å-nél kezdte és ezután egymással szinkronban folytatta a rezgést. Ezért mindegyik ugyanakkor haladt át a bûvös 6,9 Å-ön, tehát a bomlások szinte egyszerre következtek be.
Ez Zewail femtokémiájának a lényege: a femtoszekundumos impulzussal – képletesen szólva – Zewail megfújja a sípot és a molekulákat egyszerre indítja el a rezgési ciklusnak ugyanarról a pontjáról. A molekulák szinkronizálásának ("a koherens preparátumnak") az az egyik következménye, hogy bár a késõbbi impulzussal sok – milliónyi – molekulát mérnek, a mozgás nem "mosódik el", hanem a koherencia miatt a molekulák úgy viselkednek, mint egy klasszikus rezgõ test, például egy rugó. A mérés során az atommagok rezgés közbeni mozgása is megfigyelhetõ, s az átmeneti állapot nagy térbeli felbontással követhetõ (a NaI esetében kb. 0,1 Å-mel).
Sok vegyészt foglalkoztat az a kérdés, hogy egyes kémiai kötések miért reaktívabbak a többinél, és az egyenrangú kémiai kötések egyszerre bomlanak-e fel. Zewail és munkatársai a tetrafluor-dijód-etán (F2IC–CIF2 —>F2C=CF2+ I2)bomlását tanulmányozva arra az érdekes eredményre jutottak, hogy a két azonos C–I kötés egymás után hasad fel, az elsõ 200 fs, a második 100-szor ennyi idõ alatt.
Ugyancsak meglepõ eredményt hozott a benzol (C6H6) és a jód (I2) reakciójának tanulmányozása. A két molekula, egymással ütközve, komplexet képez. A lézerimpulzus hatására a benzolról elektron ugrik át a jódra: a benzol pozitív, a jódmolekula negatív töltésû lesz. A két jódatom közötti kötés megnyúlik, mivel a benzolhoz közelebbi jódatomot a benzol magához vonzza. A kötés végül elszakad, és a másik jódatom lerepül. Mindez 750 fs alatt játszódik le. Zewail kimutatta azonban, hogy nemcsak így képzõdnek jódatomok. Néha egy elektron "visszahullik" a benzolra. A jódnak azonban már késõ: a molekula szétszakad, mint a túlfeszített gumiszalag, és mindkét jódatom lerepül. A kísérletek azt illusztrálják, hogy a korábban feltételezettnél bonyolultabb reakciómechanizmusokkal kell számolnunk.
Gyakran tanulmányozott modellreakció a ciklobután gyûrûnyitási reakciója, amelynek során etilén keletkezik. A reakció lejátszódhat egyetlen átmeneti állapot kialakulásával, de két lépcsõben is úgy, hogy intermedierként tetrametilén képzõdik, s csak egy újabb gát átlépése után keletkezik a végtermék. Zewail és csoportja kimutatta, hogy valóban létrejön az intermedier, és élettartama 700 fs.
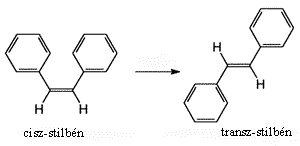
Ugyancsak femtoszekundumos spektroszkópiával tanulmányozták a stilbénmolekula fotoizomerizációját: a cisz-forma átalakulását transz-változattá. A lézerimpulzus hatására a cisz-izomer kettõs kötése meggyengült, ezért mindkét benzolgyûrû egyszerre elfordulhatott 90 fokkal, és így mintegy 300 fs alatt megcsavarodott intermedier keletkezett, majd végül kialakult a transz-változat. Hasonló, fotogerjesztéssel kiváltott, koherens csavarodást figyeltek meg más kutatók a retinál molekulán, amely a szem pálcikáiban levõ rodopszin színes anyaga. Amikor fényt érzékelünk, a legfontsabb fotokémia lépés a retinál kettõs kötésének cisz-transz átalakulása. A folyamat idõtartama 200 fs. A reakció sebessége arra utal, hogy az elnyelt foton energiája nem oszlik el, hanem a kettõs kötésen lokalizálódik. Ez magyarázatot adhat arra, hogy a szem miért lát jól éjszaka is.
A femtoszekundumos spektroszkópiával ma már felületeken, oldatokban, polimerekben, biológiai rendszerekben is végeznek vizsgálatokat. A kémiai reakciók mechanizmusának ismerete nemcsak elméleti okokból, hanem a reakciók szabályozásának szempontjából is fontos.
A femtokémia alapvetõen megváltoztatta a kémiai reakciókról alkotott képünket. Az "aktiválás", "átmeneti állapot" kifejezések mögött ma már az egyes atomok mozgását is láthatjuk. Zewail kutatásai robbanásszerû fejlõdést indítottak el a kémiában.
| Vissza | http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |