Paul D. Boyer
University of California
Los Angeles, USA
John E. Walker
Medical Research Council Laboratory
of Molecular Biology
Cambridge, Nagy-Britannia
Jens C. Skou
Aarhusi Egyetem
Aarhus, Dánia



1997 kémiai Nobel-díjasai:
|
Paul D. Boyer University of California |
John E. Walker Medical Research Council Laboratory |
Jens C. Skou Aarhusi Egyetem |
 |
 |
 |
Paul D. Boyer és John E. Walker megosztva kapta
a díj felét az ATP-szintetáz enzimmel katalizált
ATP-szintézis vizsgálatáért. Boyer és
munkatársai biokémiai adatok alapján írták
le azt a mechanizmust, amely szerint ATP (adenozin-trifoszfát) képzôdhet
az adenozin-difoszfátból (ADP) és szervetlen foszfátból.
Walker és munkatársai meghatározták az enzim
szerkezetét, és igazolták a Boyer-féle mechanizmust.
Jens C. Skou a díj másik felét kapta a nátrium-,
kálium-stimulált adenozin-trifoszfatáz (Na+,
K+-ATPáz) enzim felfedezéséért.
Ez az enzim tartja fenn az élô sejt nátrium- és
káliumionjainak egyensúlyát.
Az Fo rész három (fajtánként eltérõ számú) egységbõl áll. Az egységek fehérjék; az a típusúból 1, a b típusúból 2, a c típusúból 9-12 van. Az F1 rész ötféle egységbõl áll (alfa, béta, gamma, delta és epszilon). Az alfa- és béta-típusúból három-három, a többibõl egy-egy van. Az ATP-szintézis a béta-egységen játszódik le. Az aminosav-szekvenciák vizsgálatából kiderült, hogy a gamma-, delta- és epszilon-egység nem szimmetrikus.
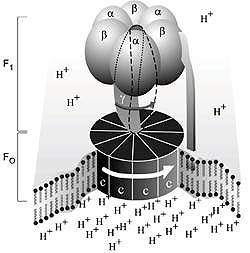
1. ábra. Az ATP szintetáz modellje.
Az Fo rész, amelyen a hidrogénionok
transzportja zajlik, a membránban van. Az ATP-t szintetizáló
F1 rész a membránon kívül
van. Amikor a hidrogénionok átáramlanak a c
egységekbõl álló korongon, a korongot elfordulásra
késztetik. Az F1 rész gamma-egysége
a koronghoz kapcsolódik, ezért vele együtt elfordul.
Az alfa- és béta-egységek azonban nem
tudnak forogni. A gamma-egység abban a hengerben forog, amelyet
a hat alfa- és béta-egység alkot. Mivel
a gamma-egység aszimmetrikus, a béta-egységeket
szerkezeti változásra készteti. Ezért a béta-egységek
nem ugyanolyan erõsen kötik meg az ATP-t és az ADP-t.
Boyer és munkatársai megállapították,
hogy az ATP-szintetáz igen különösen viselkedik.
Azt találták ugyanis, hogy - az eddigi elképzelésektõl
eltérõen - nem ahhoz kell a nagy energia, hogy az ADP-ból
és szervetlen foszfátból ATP keletkezzék, hanem
ahhoz, hogy az ADP és a foszfát az enzimhez kötõdjék,
illetve az ATP leváljon. Az ATP azonban így is tárol
energiát. Az ATP-szintetáz ebbõl a szempontból
tehát különbözik az enzimek többségétõl,
amelyek spontán módon kötik meg és bocsátják
el a szubsztrátokat, illetve a termékeket, de a katalitikus
reakciókhoz energiát emésztenek. A vizsgálatok
során az is kiderült, hogy az F1
rész aszimmetriája ellenére az enzim csak egyféle
módon reagál. De hogyan mûködhet a három
béta-egység ugyanúgy, ha különbözõképpen
kötõdik a gamma-, delta- és epszilon-egységekhez?
Boyer válasza a következõ: a gamma-, delta- és
epszilon-egység a váltakozó alfa- és
béta-egységekbõl alkotott hengerben forog.
Ez a forgás szerkezeti változásokat idéz elõ
a béta-egységben, ezárt minden ciklus során
változik a kötési képesség (2. ábra).
Ezt a jelenséget Boyer-féle "kötésváltoztató
mechanizmusnak" nevezik. Boyer szerint a forgást a membránon
zajló hidrogénion-transzport váltja ki.
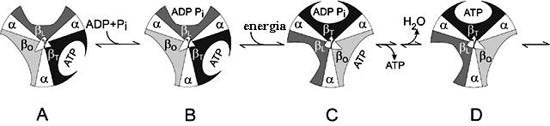
2. ábra. A Boyer-féle "kötésváltoztató
mechanizmus".
A kép a váltakozó alfa- és béta-egységekbõl
álló hengert az ATP-szintézis négy különbözõ
fázisában mutatja. Az aszimmetrikus gamma-egység,
amely a béta-egységek szekezetét megváltoztatja,
középen látható. A szerkezeteket nyitott, bétaO,
laza, bétaL, és sûrû, bétaT,
jelzõkkel látták el. Az A fázisban egy csaknem
kész ATP-molekula kapcsolódik a bétaT-hez.
A B fázishoz vezetõ lépésben a bétaL
megköt egy ADP-molekulát és egy szervetlen foszfátot
(Pi ). A C fázisban látható, hogyan csavarodott
meg a gamma-egység a hidrogénion-transzport hatására.
Emiatt a három béta-egység szerkezete módosul.
A sûrû béta-egység laza lesz, és
az ATP-molekula leválik. A laza béta-egység
sûrûvé, a nyitott lazává változik.
Az utolsó fázisban játszódik le az a kémiai
reakció, amelynek során a foszfátionok reagálnak
az ADP-molekulával, és új ATP-molekula keletkezik.
Ezzel a ciklus elejére értünk.
Boyer mechanizmusát Walker igazolta az enzim szerkezetének megállpításával. A szarvasmarhából kivont ATP-szintetáz F1 részében -- a krisztallográfiai vizsgálatok szerint -- az alfa- és béta-egységek szerkezete különbözõ, ezért különbözõképpen képesek megkötni az ADP-t és és az ATP-t. A gamma-egység aszimmetrikus tengelyként jelenik meg a három alfa- és három béta-egység hengerében, és a béta-egységek aktív felületeit arra készteti, hogy küönbözõ háromdimenziós szerkezeteket vegyenek fel. Ezek az eredmények a Boyer-mechanizmussal úgy értelmezhetõk, hogy az enzim a gamma-egységek forgása alapján mûködik. Ezt a forgást nehéz volt kísérlettel igazolni, de több csoportnak is sikerült.
Az 1920-as években már tudták, hogy az élõ
sejtek ionkoncentrációja eltér a környezet ionkoncentációjától.
A sejtekben a nátriumkoncentráció nagyobb, a káliumkoncentráció
kisebb, mint a külsõ folyadékban. Az 1950-es években
az is kiderült, hogy amikor az ideget inger éri, nátriumionok
áramlanak az idegsejtbe. A koncentrációkülönbség
úgy áll vissza, hogy a nátriumionok újra kiáramlanak.
Az is valószínûnek látszott, hogy a transzporthoz
ATP-re van szükség, mert az ATP-képzõdés
gátlása gátolta a nátriumionok transzportját.
Ennek alapján Jens C. Skou olyan ATP-bontó enzimet
keresett az idegmembránban, amely az iontranszporttal lehet kapcsolatban.
1957-ben publikálta az elsõ cikket egy nátrium- és
káliumionokkal aktivált ATP-ázról ((Na+,
K+-ATPáz). Õ írt le
elõször olyan enzimet ("ionszivattyút"), amely
a sejtmembránon áthaladó anyagok irányított
transzportját segíti elõ. Azóta több enzimrõl
is kimutatták, hogy hasonló hatást fejt ki.
Skou finomra ôrölt rákideg-membránnal dolgozott. A készítményben levô ATP-bontó enzimet -- magnéziumionok jelenlétében -- a növekvô mennyiségû nátriumion egy határig stimulálta. Efölött kis mennyiségû káliumion váltott ki további stimulációt. A legerôsebb stimuláció az idegben elôforduló szokásos nátrium- és káliumion-koncentrációknál következett be, ami arra utalt, hogy az enzim "ionszivattyúhoz" kapcsolódik. A további vizsgálatok során Skou kimutatta, hogy a nátrium- és a káliumionok az enzim különbözô helyeihez kötôdnek nagy affinitással, és az ATP-rôl lehasadt foszfátcsoport szintén az ATPázhoz kötôdik. Az enzimet a nátriumionok akkor befolyásolják, ha foszforilezôdik, a káliumionok pedig akkor, amikor defoszforilezôdik. A nátrium-/kálium-transzportot egyes digitálisz alkaloidok gátolják.
Skou és mások munkája nyomán lassan körvonalazódott,
hogy az enzim két részbôl áll (alfából
és bétából). Az elsô hordozza
az enzim aktivitását, a másik valószínûleg
a szerkezetet stabilizálja. Az enzimmolekulák -- gyakran
kettesével -- a sejtmembránban ülnek; felületükbôl
kifelé is, befelé is mutatnak egy-egy részt. Három
nátriumion és egy ATP kötôdik a belsô felülethez,
majd az ATP egy foszfátcsoportja átadódik az enzim
egyik aminosavjának (az aszparaginnak), az ADP felszabadul, és
az enzim úgy változik, hogy a nátriumionok kívülre
szállítódnak. Itt leválnak, és helyettük
két káliumion kötôdik meg. Amikor az enzimhez
kötôdô foszfor távozik, a káliumionok a
sejtbe kerülnek, és akkor lökôdnek le, amikor új
ATP kötôdik az enzimhez. Mivel több nátriumion jut
ki, mint amennyi káliumion vándorol be, elektromos potenciálkülönbség
lép fel a membránban.
Ez a potenciálkülönbség a feltétele annak,
hogy egy idegrostban vagy egy izomsejtben ingerület haladhasson. Az
agy tápanyag- vagy oxigénellátásának
hiánya ezért vezet gyorsan eszméletvesztéshez,
hiszen ilyenkor az ATP-képzôdés megszakad, és
az ionszivattyú leáll. A szivattyú a sejttérfogat
fenntartásában is fontos szerepet játszik. Ha a szivattyú
leáll, a sejt megduzzad. A sejt belseje és külseje közötti
nátriumkoncentráció-különbség hatására
veszi fel a sejt a különbözô fontos tápanyagokat,
például a glükózt és az aminosavakat.
A koncentrációkülönbség nyomán indulhat
meg más ionok transzportja: a belépô nátriumionok
kilépô kalciumionokra cserélôdhetnek. A digitálisz
ezzel a mechanizmussal erôsíti a szívmûködést.
A Na+, K+-ATPáz
felfedezését követôen több hasonló
szerkezetû és mûködésû ionszivattyút
találtak. A Ca2+-ATPáz például
az izomösszehúzódásban vesz részt, a H+,
K+-ATPáz sósavat állít
elô a gyomorban. A gyomorfekély kezelésekor újabban
ennek az enzimnek a mûködését gátolják.
Az alacsonyabb rendû szervezetekben is elôfordulnak hasonló
enzimek. Az élesztôben például egy H+-ATPáz
választja ki az erjedés során keletkezô hidrogénionokat.
GÁRDOS GYÖRGY– SARKADI BALÁZS: Az ATP - az élet tüzelôanyaga
Forrás
A Svéd Tudományos Akadémia sajtóközleménye
Nobel-díjasok Internet-archívuma, kémiai
Nobel-díjasok
| Vissza a cikkgyûjteményhez | http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |