Saját vizsgálataink, amelyek jelenleg ismertetésre kerülnek, elsôsorban az adenovírus hexon fehérje antigénszerkezetére vonatkoznak. Az ikozaéder alakú vírusrészecske (virion) fehérjeburkát alkotó 252 morfológiai egység (kapszomer) közül 240 a hexon, melyek közül 120 helyezkedik el az éleken és 120 a háromszögletû lapokon. Minden komplett hexon három, kémiailag azonos alegységbôl áll (1. ábra). A hexonok felszínén számos különbözô specificitású antigéndetermináns, epitóp található, melyek pontos ismerete rendkívül fontos szerepet játszik a génterápiás és rekombináns vakcinálási kísérletek hatékonysága szempontjából (6-10).
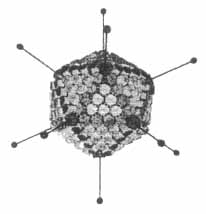
1. ábra. Adenovírus-modell. Szemlélteti az ikozaéder alakú vírusrészecske élein és lapjain szabályosan elhelyezkedô hexon kapszomereket, az ezeket alkotó három strukturális alegységet és a szomszédos hexonokat összekötõ finomszerkezeti elemeket, továbbá a csúcsokon levô kapszomereknek (pentonok) radiálisan kiálló nyúlványait (fiber), végükön kis gömbszerû képzõdményekkel
Mielôtt azonban rátérnék az emlitett témakörben végzett vizsgálataink néhány részletének ismertetésére, szeretnénk köszönetet mondani munkatársainknak áldozatos munkájukért. Kutatócsoportunk és Intézetünk tagjai közül az elôadásra kerülõ munkák egy-egy részében a felsorolt munkatársak vettek részt: Dobay Orsolya, Jeney Csaba és Lengyel Anna. A kísérletek egy-egy része együttmûködésben folyt több hazai és külföldi intézet munkatársaival, akiknek szintén szeretnénk köszönetünket kifejezni.
Nagyfokban tisztított és részben kristályosított hexon készítmények segítségével elôállított nagyszámú monoklonális ellenanyag és több, mint 20 szerológiai típusba tartozó hexonpreparátum vizsgálata alapján kimutattuk, hogy a különbözô hexontípusokon az adenovírus genusra és a szerológiai típusra specifikus epitópokon kívül nagyszámú, ún. intertípus specifikus (1T) epitóp is létezik. Ezek az IT epitópok egymástól is különböznek és az adott szerotípustól fûggõen különbözô kombinációkban vannak jelen a hexon felszínén (9, 11). A monoklonális ellenanyagok specificitását, azaz epitópelkülönítô képességét szigorú kritériumok alapján határoztuk meg, az ellenanyagok hexontípusok közötti keresztreagálási képességének, titerének, mértékének és korrelációs koefficiensének segítségével. Ilyen módon összesen 18 különbözô IT specifikus epitópot sikerült elkülöníteni. Kimutattuk, hogy egy adott IT epitóp a megfelelô specifikus monoklonális ellenanyaggal azonosítható, de azzal a két hexontípus csoporttal jellemezhetô (definiálható), melyek tagjain az adott monoklonális ellenanyaggal kimutatható a jelenléte, illetve amelyeken nem (7–9, 11 ).
Mind a 18 IT specifikus epitópot sorrendbe rakva, a különbôzô adenovírus hexontípusokon való jelenlétük vagy hiányuk alapján kiderült, hogy szinte lineárisan, fokról fokra csökken azoknak a szerotípusoknak a száma, amelyeken jelen van az adott epitóp és ezzel párhuzamosan növekszik azon szerotípusoknak a száma, amelyeken hiányzik. Világosan utal ez a kép az antigén rokonság fokára, mértékére az egyes hexontípusok között és az egymásból való kifejlõdés lehetõségére is. Kis túlzással azt lehetne mondani, hogy ez a jelenség az evolúció egy kis mozzanatát engedi sejteni, de annyi mindenesetre biztos, hogy új taxonómiai és diagnosztikai lehetõségeket tár fel. Igazi jelentôsége azonban a rekombináns adenovírusok alkalmazása területén van. Ugyanis a rekombináns adenovírusok alkalmazásának egyik nehézsége a recipiens szervezet immunválasza, ellenanyag-termelése a rekombináns vektorvírus saját fehérje antigénjei ellen, amelyek csökkentik, második vagy többszöri kezelés esetén pedig teljesen megakadályozhatják a kezelés hatását, hiszen az összes IT epitóp ellen képzôdött ellenanyag érezteti káros hatását, amely az alkalmazott rekombináns adenovírus típus hexonján jelen van. Ez pedig hexontípusonként változó, egyiken több, másikon kevesebb és másféle IT epitóp van jelen (7–9, 12, 13).
Ezek alapján az a javaslatunk, hogy rekombináns adenovírus kezelésre a génterápia során más-más szerotípusból készített vektor kerüljön alkalmazásra második vagy többszöri kezelésre egy adott beteg esetében. Mégpedig olyan adenovírus típusokból, amelyek antigénszerkezete epitóp összetéteiben a lehetõ legtávolabb állnak egymástól. Ennek meghatározására pedig egy rendszert dolgoztunk ki az adenovírusok 1T specifikus epitópjainak, antigénrokonsági fokának két-két típusonként történô páros összehasonlitása alapján. Ezt mutatjuk be a táblázaton.
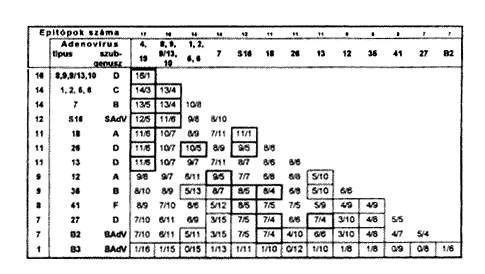
A felsõ vízszintes és a függôleges oszlopokban a vizsgált hexontípusok láthatók. A találkozási pontokban található keretekben az elsõ szám az azonos, a második szám pedig az eltérô epitópok számát mutatja két-két adott adenovírus típus esetében. A vastag keretek által meghatározott típusok nagyfokú rokonságot mutatnak, a vékony keretek által meghatározott típuspárok esetén pedig, mint látható, kétszer-háromszor több az eltérô epitópok száma, mint az azonosaké. Tehát ezekbôl a típusokból érdemes rekombináns adenovírus párokat készíteni a recipiens szervezet immunválasza káros hatásának csökkentése vagy elkerülése céljából (2, 3, 9).
Az IT specifikus epitópok valószínû számának
és lokalizációjának a meghatározására
Hudecz Ferenccel (MTA Peptidkémiai Kutatócsoport, ELTE) egyûttmûködésben
számítógépes epitóp predikciós
eijárásokat végeztünk a 2-es és 41-es
típusú humán adenovírus hexonfehérje
aminosavszekvenciáján a b-kanyar
képzô készség és a hidrofilitási
profil áital meghatározott potenciális epitóp
szekvenciák kiválasztásával (14). Mindkét
típusban találtunk közösen jelenlévõ,
azonos vagy hasonló aminosavszekvenciával rendelkezõ,
potenciális IT specifikus epitópokat, de találtunk
17 nem közös, csak egyik típuson prediktálható
potenciális epitópot is, amely még nagyobb számú
epitóp létezésének lehetôségére
hívja fel a figyelmet a hexonfehérjén, mint ami monoklonális
ellenanyagok segítségével kimutatható volt.
A prediktált epitópok szekvencia sorszáma alapján
meghatároztuk az epitópok helyzetét is a komplett
hexont alkotó három azonos fehérje alegység
háromdimenziós modelljén is.
Az antigenitás és az immunogenitás vizsgálata
céljából két prediktált epitópnak
megfelelô peptidet szintetizáltunk és carrier-hez konjugáltunk
Hudecz Ferenccel, illetve Mezô Imrével és munkatársaikkal
való együttmüködésben [15). Az egyik szintetizált
peptld csak a 2-es típusban került prediktálásra.
hasonló, vagy rokon szekvenciák nem voltak találhatók
sem a 41-es, sem 15 más, különbözõ típusú
hexonban sem. A másik szintetizált peptid mindkét
típusban prediktálásra került és részben
teljesen homológ, részben szoros rokonságot mutató
szekvenciák voltak találhatók 15 más típusú
hexonban is. A szintetizált peptid-carrier konjugátumokkal
a tisztított hexonok ellen termelt egyes monoklonális ellenanyagok
reakcióba léptek és a konjugátumok ellen termelt
antitestek felismertek különbözô típusú,
tisztított, natív hexon antigéneket ELISA reakcióban.
Tehát a szintetizált biokonjugátumok antigén
és immunogén tulajdonságúnak bizonyultak. További
hasonló és más jellegû vizsgálatok újabb
4 szintetizált peptiddel is folyamatban vannak az epitópok
szerkezetének és tulajdonságainak tanulmányozása
céljából (11).
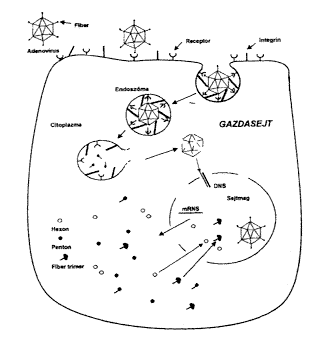
2. ábra. Az adenovírusok bejutása a gazdasejtbe.
A nyúlványok végén levõ gömbszerû
képzôdmény kapcsolódik a sejtmembrán
felszínén levô receptorhoz. Ezután az integrinek
segítségével a sejtmembrán betüremkedése
következtében bejut a citoplazmába egy endoszómába
zártan, majd az endoszóma fala és a vírus fehérjeburka
széttöredezik, kiszabadul a vírus DNS és bejut
a sejt magjába. Innen specifikus mRNS-molekulák vándorolnak
a citoplazmába a különbözõ vírusfehérje
"alkatrészek" termelésének kódolására,
amelyek visszajutva a sejtmagba kialakítják a komplett fertõzõképes
új vírusokat
Az adenovírus-fertôzések patomechanizmusának területén arra vonatkozóan vannak folyamatban vizsgálatok, hogy a fertôzési folyamat melyik szakaszában, melyik vírusfehérje, melyik sejtfehérjével lép kapcsolatba az új vírusrészecskék termelôdése folyamán. Elôször a vírus partikula részben a receptorok és részben az integrinek segítségével bejut a sejtbe, ezután a vírus DNS a fehérjeburokból kiszabadulva bejut a sejtmagba, ahol mRNS képzõdik róla, majd az mRNS visszakerül a citoplazmába, ott irányítja a különféle vírusfehérjék termelését, amelyek az érett vírusrészecskék kialakításához visszajutnak a sejtmagba (2. ábra). Ez alatt a folyamat alatt számos különbözõ vírusfehérje léphet interakcióba számos különbözô sejtfehérjével. Ezt a kérdést elõször a hexonfehérje vonatkozásában tettük vizsgálat tárgyává az ún. két-hibrid rendszer (THS, Two Hybrid System) segítségével. Ez a módszer azon alapszik, hogy a Saccharomyces cerevisiae Gal4-es transzkripciós faktora két régióból áll: DNS-kötô és aktiváló régióból. A natív Gal4 aktiválja egy riporter gén (pl. b-galactosidase) expresszálódását (16). A két régió génjei egymástól szeparálhatók, elválaszthatók, plazmidba építhetôk és ismert vagy ismeretlen fehérjék köthetôk hozzájuk gén szinten. A DNS-kötô részhez kötjük a hexon gént (elsô hibrid), az aktiváló részek egy-egy példányához pedig külön-külön sok-sok ismeretlen sejtfehérje gént tartalmazó cDNS könyvtárból más-más sejtfehérje génje kötôdik (második hibrid). Élesztõsejtben való expresszálódás után ebbõl a sejtfehérje halmazból a DNS-kötô rész fehérjéje maga választja ki azt az aktiváló rész és sejtfehérje hibridet, amelynek fehérje része képes interakcióba lépni a DNS-kötô részhez kôtödött ismert vírusfehérjévei (hexon) és ezáltal helyreáll a Gal4-es transzkripciós faktor aktivitása (3. ábra). A riporter gén mûködése alapján kiválasztható az a sejt, amelyikben az aktív Gal4 transzkripciós faktor van és az ismeretlen sejtfehérje génje szeparálható, szekvenálható és ezáltal az ismeretlen fehérje meghatározható.
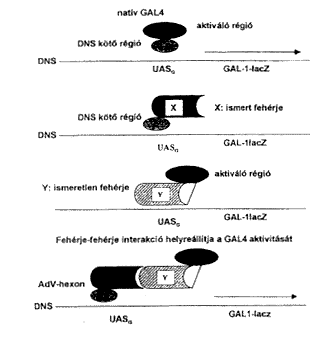
3. ábra. Két-hibrid rendszer mûködésének elve két különbözô – vírus- és sejteredetû – fehérje interakciójának kimutatása céljából. Bôvebb magyarázat a szövegben
Röviden összefoglalva eredményeinket: monoklonális ellenanyagok segítségével kimutattuk, hogy az adenovírus hexonfehérjén legalább 18 különbôzô intertípus specifcitású, korábban nem ismert epitóp létezik. A hexon polipeptid alegységének aminosavszekvenciáján végzett számítógépes predikciós eljárásokkai meghatároztuk a potenciális intertípus specifikus epitópok aminosavszekvenciáit. Ezek egy részét szintetizáltuk és carriermolekulákhoz kötött biokonjugátumok formájában tanulmányozva bizonyítottuk antigén és immunogén képességüket.
Eredményeink szerlnt az intertípus specifikus epitópok fontos szerepet játszanak a kísérletes génterápiában és a rekombináns adenovírus védôoltásban, a rekombináns vektorok saját fehérje antigénjei ellen a recipiens szervezetben kialakuló káros hatású immunválaszban. Ennek elkerülésére a második, vagy többszöri rekombináns kezelésre ugyanannál a betegnél más-más adenovírus szerotípusból készített rekombinánst javaslunk alkalmazni, amelyek antigénszerkezete, epitóp összetétele eltérõ egymástól. Az epitóp összetétel meghatározására és a megfelelô típuspárok kiválasztására összehasonlító rendszert is kidolgoztunk.
IRODALOM
1 Nász I. (1986) Az adenovírusok patológiai jelentõsége
és molekuláris szerkezete. Akadémiai Kiadó,
Budapest. 1-58.
2 Nász l. Ádám É. (1997) Újabb fejlemények
és irányzatok az adenovirus-kutatásban. Orv. Hetil.
138/43. 2711-2724.
3 Ádám É. Nász I (1995) A rekombináns
adenovírusok jetentôsége a kísérletes
génterápiában. Orv. Hetil. 136/15, 755-761.
4 Randrianarison-Jewtoukoff V, Perricaudet M. (1995) Recombinant adenoviruses
as vaccine. Biologicals, 23, 145-157.
5 Siegfried W. (1993) Perspectives in gene therapy with recombinant
adenoviruses. Exp. Clin. Endocrinol, 101. 7-11.
6 Nász I. Ádám É (1991) Characterlzation
of the antigenic structure of adenovirus hexons by means of monoclonal
antibodies. UNESCO-ROSTE Techn. Rep. 6. 66-79.
7 Ádám É, Nász l. Lengye! A. (1995) Antigenic
homogeneity among the adenovirus hexon types of subgenus C. Arch Virol,
140. 1297-1301.
8 Ádám É, Ncísz I, Lengyel A. (1995) Diversity
in the antigenic structure of different hexon types among the members of
adenovirus subgenus D. Acta Microbiol. Immunol. Hung, 42, 85-92.
9 Ádám É, Nász l, Lengyel A. (1996) Characterization
of adenovirus hexons by their epitope compositlon. Arch. Virol, 141, 1891-1907.
10 Russel WC. Adrian T. Bartha A. Fujinaga K, Ginsberg HS. Hierholzer
JC, de Jong JC. Li QG, Mautner V. Nász l. Wadell G. (1995) Adenoviridae.
In: Murphy FA, Faquet CM, Bishop DHL. Ghabrial SA. Jarvis AW. Martelli
GP. Mayo MA. Summers MD (eds) Virus Taxonomy. Sixth Report of the Internattonal
Committe on Taxonomy of Viruses, Springer, Wlen -New York, 128-133. (Arch
Virol [Suppl) 10)
11 Ádám É. Nász I. Hudecz F. Lengyel A.
Mezõ G, Dnbay O. (1998) Characterization of intertype specific epitopes
on adenovirus hexons. Arch. Virol, 143, 1669-1682.
12 Douglas J.T., Curiel D.T. (1997) Adenoviruses as vectors for gene
therapy. Sci. Med. 4, 44-53.
13 Kagami H, Atkinson J.C. Michalek S.M. Handelman B. Yu S. Baun B.J..
O'Connel B. (1998) Repetitive adenovirus administration to the parotid
gland: Role of immunological barriers and induction of oral tolerance.
Hum. Gene Ther. 9, 305-313.
14 Hudecz K. (1994) Prediction of B- and T-cell epitopes. In: Rajnavölgyi
É. (ed) Synthetic peptides in the search for B- and T-cell epitopes.
RG Landes Company, Austin, 19-30.
15 Hudecz F. (1995) Design of synthetic branched chain polypeptides
as carriers for bioactive molecules. Anti-Cancer Drugs, 6. 171-193.
16 Fields S. Sternglanz R. (1994) The two-hybrid system: an assay for
protein-protein interactions. Trends in Genetics, 10, 286-292.