Polimer terapeutikumok
Az 1990-es évek közepén új, a hagyományostól alapvetôen eltérô típusú gyógyszerek klinikai bevezetését engedélyezték a világ néhány fejlett országában. A jelenleg használatban levô gyógyszerek kis méretû molekulák, ezzel szemben az új készítmények hatóanyaga polimert tartalmaz. Kifejlesztésükre vezetô gyógyszergyárak jelentõs anyagi és szellemi forrásokat fordítottak, fordítanak. Vajon miért van szükség ezekre a vegyületekre, a gyógyszerkutatásban forradalminak számító új irányzat megjelenésére? A válasz szinte kézenfekvô: a hagyományos gyógyszerek több kórkép, elsõsorban daganatos megbetegedések esetében alkalmatlannak bizonyultak. Sokszor még a hatékony szert sem lehet optimális dózisban alkalmazni, mert toxikus mellékhatások lépnek fel.
A polimeralapú gyógyszerek kutatása koncepcionálisan
is eltér a klasszikus felfogástól, többen a XXI.
század egyik ígéretes talán a kombinatorikus
kémia mellett legjelentôsebb irányzatának
tekintik. E vegyületekre a "polimer terapeutikum" kifejezés
1996-tól terjedt el a szakirodalomban. A kifejezés azt tükrözi,
hogy a gyógyszer szintetikus polimert tartalmaz és orvosbiológiai
kísérletekben terápiás hatás kifejtésére
alkalmas.
A polimer terapeutikumok csoportosítása szerkezetük alapján
A polimer terapeutikumok olyan, egy-három komponenst tartalmazó vegyületek, amelyek közül az egyik alkotórész szintetikus polimer. A fô szerkezeti típusokat az 1. ábra foglalja össze.
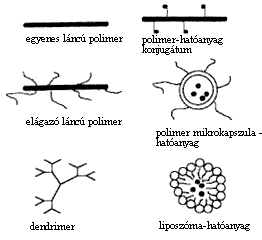
1. ábra. A polimer terapeutikumok fõ csoportjai
Egy komponenst tartalmazó polimer terapeutikumok
Csupán egyetlen komponenst tartalmaz a 20 éves kutatómunka
után, 1997-ben bevezetett szintetikus polimer, amelyet a multiplex
sclerosis kezelésére Copaxone® néven hoztak forgalomba
(1). Az elsõ polimer gyógyszer használatát
több országban (USA, Kanada, Izrael, Argentína, Szlovénia,
Oroszország) engedélyezték, máshol, így
például Magyarországon az engedélyezési
eljárás folyamatban van.
A Weizmann Intézet (Rehovot, Izrael) munkatársai által kikísérletezett vegyület egyenes láncú (lineáris) polimer polipeptid, amely négyféle aminosavból (Glu, Ala, Lys, Tyr) épül fel (1. ábra). A poli(Glu1,41,8 Ala4,15,8 Lys3,24,2 Tyr1,0) képlettel és Mw = 7250 átlagos molekulatömeggel jellemzett vegyületben az aminosavak kapcsolódási sorrendje statisztikus. A Copaxone® a T fehérvérsejtekhez kapcsolódva fejti ki hatását. Elônye, hogy az aminosavak közötti kötés fiziológiás kôrülmények között a fehérjékhez hasonlóan felhasad a szervezetben, a vegyület alkotórészeire bomlik és nem halmozódik fel a szövetekben.
A biológiailag aktív elágazó láncú polimerek kutatásának jelentõs hazai hagyományai vannak. Az MTA-ELTE Peptidkémiai Kutatócsoportjában Szekerke Mária munkássága nyomán már az 1970-es évek elejétôl folynak vizsgálatok az aminosavakból felépülô vegyületekkel. Fontos jellemzõjük, hogy bennük a "gerinchez" ugyancsak aminosavakból álló "oldalláncok" kapcsolódnak. Az oldalláncok felépítésével jelentôs mértékben befolyásolni lehetett a vegyület tulajdonságait. Csoportunk kollaborációban Gaál Dezsõvel (Országos Onkológiai Intézet) elôször mutatta ki az irodalomban, hogy nagy molekulatömegû (átlag Mw = 40 000) elágazó láncú polipeptidek képesek ellensúlyozni tumorellenes kemoterápiás szerek (vinblasztin, daunomicin), valamint radioaktív sugárzás immunrendszert károsító (immunszuppresszív) hatását (2,3).
Igen nagy jövôt jósolnak a "molekuláris fa" (dendrimer) típusú polimereknek (4). Csupán kémiai szintézisükrõl 1991 és 1996 között több mint 600 közlemény jelent meg. E vegyületek az elôkísérletek szerint alkalmasak lehetnek kisebb-nagyobb nukleinsavrészek (oligonukleotidok, gének) sejtekbe történô bevitelére (5). Így alkalmazásuk a génterápiában tûnik perspektivikusnak.
Két komponenst tartalmazó polimer terapeutikumok
Az elsô "polimer terapeutikum", amelyet a humán gyógyászatban
alkalmaztak, kétféle komponenst foglalt magában: enzimet
és polietilénglikol (PEG) polimer láncokat. Az 1990-es
évek elejétôl enzimhiányos betegeket kezeltek
PEG-láncokat tartalmazó adenozin-demináz enzimmel
(ADA). Észrevették ugyanis, hogy ha az enzimet önmagában
juttatják a szervezetbe, a fehérjével szemben immunreakció
lép fel, és már a második kezelés veszélyessé
válik. Ugyanakkor, ha a módosított fehérje
amely ADAGEN néven került forgalomba ismételt kezeléseket
tett lehetôvé, a betegek gyógyítása eredményesebb
volt (6). Az amerikai Food and Drug Administration 1994-ben engedélyezte
egy másik, ugyancsak PEG-tartalmú enzimkészítmény
(L-aszparagináz, Ekzon Inc.) alkalmazását tumoros
betegeken. Ez a szer lehetôvé tette azoknak az akut limfoblasztos
leukémiában szenvedõ betegeknek a kezelését
is, akik egyébként allergiás reakciót mutattak
a "szabad" enzimmel szemben. A polimer láncok jelenléte mindkét
esetben jelentôsen csökkentette az enzimmel szemben fellépô
immunválaszt. Ezenkívül pedig a polimerrel módosított
enzim hosszabb ideig volt jelen a vérkeringésben, ami további
jelenõös hatásnövekedést eredményezett
(7).
A két komponensbôl álló polimer terapeutikumok családja a legnépesebb. A szakirodalomban gyakran nevezik az efféle vegyületeket polimer-hatóanyag konjugátumnak is (1. ábra). Ez a kifejezés azt hangsúlyozza, hogy kétféle, önmagában is aktív alkotórész kapcsolódik össze. E vegyületek szintézisénél az a cél, hogy kémiai kötés kialakítása után is megmaradjon a biológiai hatás. Ilyen konjugátumok közé tartozik a Japánban kikísérletezett neocarcinostatin tumorellenes szert tartalmazó készítmény. Egy másik konjugátumban az Angliában vizsgált, tumorellenes hatású, klinikai használatban levô adriamicin kapcsolódik polimerhez. Mindkettôrôl lesz még szó a késôbbiekben.
A konjugátumok polimer komponense lehet olyan vegyület, amely képes lebomlani (pl. polipeptid, politejsav), és az alkotórészek (pt. aminosavak, tejsav) távoznak a szervezetbôl vagy újrafelhasználódnak. Érdekes, hogy kipróbáltak az élô szervezetben lebomlani nem képes polimereket is (pl. polisztirol, PEG, maleinsav és sztirol kopolimerje). Ezek a szervezetbõl lebomlás nélkül távozhatnak (pl. a vesén keresztül), vagy felhalmozódhatnak bizonyos szövetekben, ami terápiás alkalmazásuknak gátat szabhat. Kompromisszumos megoldásnak is tekinthetô olyan polimerek alkalmazása, amelyek részlegesen bomlanak: rendszerint lebomlani nem képes gerincbôl és enzimek által a szervezetben hasítható oldalláncból épülnek fel. A hatóanyag ilyen esetben az oldalláncon keresztül kapcsolódik a gerinchez.
A kétkomponensû polimer terapeutikumok közé tartoznak a polimer mikrokapszulákba vagy polimer micellákba zárt hatóanyag-kombinációk (1. ábra). A mikrokapszula burkát alkotó polimer molekulák között kovalens kötés van, és a hatóanyag a burok lebomlásával párhuzamosan felszabadul. A kapszula-polimerek összetétele, szerkezete jelentôsen befolyásolja a szervezetben történô lebomlás mértékét, gyorsaságát. Például a politejsav vagy a tejsav/glikolsav polimer mikrokapszulákkal, amelyek a szervezetben hidrolízis során tejsav, illetve glikolsav monomerekre bomlanak, ígéretes kísérletek folynak GnRH hormonanalógok, retard hatású készítmények kifejlesztése céljából (8). A polimer micellák esetében általában a burkot alkotó polimer molekulái között másodlagos, kevésbé erõs kölcsönhatások vannak jelen (1. ábra). Ezért a hatóanyag felszabadulásához a burok lassú "szétesése" vezet. Ilyen tumorellenes szert (doxorubicin vagy ciszplatin) tartalmazó PEG/poli-a-aszparaginsav felépítésû polimer micellákat állított elô Kataoka. Ebben az évben beszámoltak arról, hogy a készítmény in vitro körülmények között ígéretes hatást mutatott C-26 adenokarcinoma sejteken (9).
Három komponenst tartalmazó polimer terapeutikumok
A polimer terapeutikomok közé sorolhatók azok a
háromkomponensû rendszerek is, amelyekben az alkotórészek
kovalens és/vagy nem kovalens kötéssel kapcsolódnak
egymáshoz. Ilyen típusú vegyületeket hoztak létre
liposzómák felhasználásával. A liposzómák
burkát polimerrel módosították, a belsô
tér pedig tartalmazza a hatóanyagot. A polimert nem tartalmazó
liposzómákkal szemben kimutatható volt, hogy a PEG
polimer láncok jelenléte növeli a liposzóma stabilitását
és kedvezõen befolyásolja farmakokinetikai tulajdonságait
(pl. stabilitását a vérkeringésben). Antraciklin
típusú tumorellenes szert (doxorubicin, epirubicin) tartalmazó
polimer liposzómákkal jelentõsen növelni lehetett
a szer felhalmozódását limfoma modellrendszerben (10).
Az elsô antraciklin-liposzóma készítmény
rutinszerû alkalmazását 1996-ban engedélyezték
Kaposi-szarkoma kezelésére.
Polimer terapeutikumok: a laboratóriumtól a klinikai alkalmazásig
Az alábbiakban három vegyület bemutatásával szeretnék áttekintést adni arról, hogyan juthat el egy ígéretes, polimertartalmú vegyület a laboratóriumban állatkísérletekben ígéretes szer a gyógyításban való kipróbálásig, alkalmazásig. Az "úttôrô" a klinikai gyakorlatban bevezetésre került poli(sztirol-maleinsav) neocarcinostatin (SMANCS) konjugátum, amelyet Japánban fejlesztettek ki. Az európai laboratóriumok kollaborációjaként hozták létre a doxorubicin-N-(2-hidroxi-propil)-metakrilamid (PKl) konjugátumot, amely a klinikai kipróbálás elôrehaladott fázisában van. Saját kutatócsoportunkban szisztematikus szerkezet-hatás összefüggések alapján állítottuk elô azt a daunomicintartalmú polimerszármazékot, amely állatkísérletekben igen biztató tumorellenes hatást mutatott.
A fenti felsorolásból is látszik, hogy a polimerekhez kapcsolt gyógyhatású vegyületek közül a tumorellenes szerek konjugátumai kiemelt szerepet kaptak. Ennek egyik oka az, hogy a makromolekulákhoz (idetartoznak a nagy molekulatömegû polimerek is) kötött hatóanyag sejtekbe kerülésének útja más, mint a szabad hatóanyag-molekuláké. Ezt szemlélteti vázlatosan a 2. ábra. Míg a nagy molekulákat a tumorsejtek képesek bekebelezni (endocitozis), a tumorellenes szer kis molekuláit (hatóanyagot) minden sejt felveheti diffúzió útján. A polimer jelenléte tehát lehetôséget nyújt arra, hogy a szer elsôsorban a tumorsejtekbe jusson el. Ezért polimer konjugátum alkalmazása elõsegíti a hatóanyag tumorbeli dúsulását és csökkenti a szabad hatóanyaggal történô kezeléseknél tapasztalt mellékhatásokat (1113).
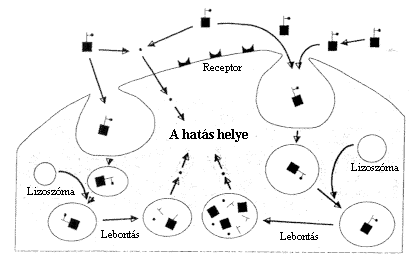
2. ábra. Makromolekulához kovalensen kapcsolt hatóanyag sejtbe történô felvétele endocitózissal
Poli(sztirol-maleinsav)neocarcinostatin konjugátum (SMANCS)A
mai klinikai gyakorlatban használt, elsô tumorellenes polimer
terapeutikumot Maeda és munkatársai fejlesztették
ki. 1986-ban megfigyelték, hogy a tumorok mérete csökken
abban az esetben, ha a tumorgátló "szilárd" (solid)
szert nem önmagában, hanem polimerhez kovalensen kapcsolt formában
adják az állatoknak (14). Ez a felismerés egy évtizedes
kutatás után lehetôvé tette, hogy 1993 szeptemberében
Japánban engedélyezzék májtumorban szenvedô
betegek kezelését polimertartalmú tumorellenes szerrel.
A konjugátum (rövidítése: SMANCS) hatóanyaga a neocarcinostatin (NCS), amely két aminocsoportján keresztül kapcsolódik egy-egy szintetikus sztirol/maleinsav kopolimer molekulához (SMA) (15).
E vegyület hatásának tanulmányozása során megfigyeiték, hogy az NCS kapcsolása a makromolekulához jelentôs mértékben megváltoztatta annak szervezetbeli eloszlását. Intravénás kezelést követôen a szabad tumorgátló szer gyorsan távozott a vérkeringésbôl, míg az NCS-polimer konjugátum jelenléte 2472 óra után is kimutatható volt. A keringésben hosszabb eltöltött idô azonban csak részben adott magyarázatot a tumorban észlelt SMANCS dúsulásra. A Maeda által "enhanced permeability and retention" (EPR) effektusként leírt jelenség szerint a "solid" tumorok környezetében a véredények áteresztôképessége, valamint a nyirokrendszer sejtjeinek mûködése eltér az egészséges szöveteknél tapasztaltaktól (3. ábra).
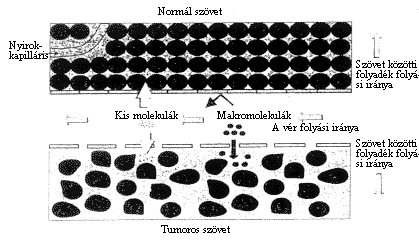
3. ábra. A véredények átjárhatósága egészséges és tumoros szövetek környezetében
Megfigyelték, hogy a tumor közelében a vérerek
fala áteresztôvé válik a makromolekulákra
nézve. Mivel a nyirokrendszer nem képes hatékonyan
eltávolítani a nagy molekulákat, a tumor környezetében
a SMANCS felhalmozódását lehetett tapasztalni. Késôbb
más kutatócsoportok köztük saját vizsgálataink
is megerôsítették az EPR-effektus létezését.
Bebizonyosodott az is, hogy a hatóanyag konjugált formában
101000-szer nagyobb koncentrációban lehet jelen intravénás
alkalmazás után. A dúsulás mértéke
a polimer komponens nagyságától és kémiai
szerkezetétôl jelentôs mértékben függ.
Májrákos (hepatocarcinoma) betegek kezelésérôl
közölt adatok szerint 322 betegbôl 308 (96%) esetben tapasztalták
a tumor méretének jelentôs (50%-ot meghaladó)
csökkenését a SMANCS intravénás adagolását
követôen. Az egyébként inoperábilis betegek
átlagos túlélése a kontrollcsoporthoz képest
544 nap volt (16). Mivel az angliai (University of Birmingham) klinikai
kipróbálás adatai is igen kedvezôek, hamarosan
várható a szer engedélyezése európai
országokban is.
N-(2-hidroxi-propil)metakrilamid (HPMA) - konjugátum
Angol és cseh kutatócsoportok dolgoznak egy másik
ígéretes polimer terapeutikum fejlesztésén.
Ennek polimer komponense közeli rokona annak a Prágában
létrehozott polimernek, amelynek térhálósított
származéka a lágy (soft) kontaktlencse alapanyaga.
A konjugátum gerincét a SMANCS-hoz hasonlóan a
szervezetben lebomlani nem képes polimer képezi.
Ugyanakkor a kutatók olyan tetrapeptid oldalláncokat is kiépítettek, amelyek a szervezetben enzimek hatására elhasadnak. A konjugátumban a peptid oldalláncokhoz kapcsolták az antraciklin típusú tumorellenes szerek közé tartozó doxorubicint. A hatás kifejtéséhez a doxorubicin felszabadulására van szükség, ami a proteázok által elhasított peptidkötések felbomlásával jöhet létre (17).
Egereken végzett kísérletek azt mutatták,
hogy a doxorubicin-N-(2-hidroxi-propil)metakrilamid (HPMA) konjugátum
70-szer nagyobb koncentrációban volt jelen a tumorban, mint
a szabad doxorubicin. A jelentôs dúsulás és
más elônyös tulajdonságok alapján a Prágában
és Keele-ben dolgozó kutacsoportokról elnevezett PKI
prototípus készítmény jelenleg a klinikai kipróbálás
stádiumábari van. Az elsô publikált adatok szerint
a PKI maximális tolerálható dózisa jóval
nagyobb (320 mg/m2), mint a klinikai gyakorlatban alkalmazható
doxorubicin dózis (6080 mg/m2) (17). HPMA-típusú
polimerek felhasználásával más tumorellenes
hatású konjugátumok szintézisérôl
és kipróbálásáról is jelennek
meg adatok az irodalomban. Így például a Pharmacia/Upjohn
támogatásával elkészült és klinikai
kipróbálás elôtt áll a paclitaxel (Taxol®)
tartalmú konjugátum (18).
Elágazó láncú poliptidek konjugátumai
A polimer konjugátumok tulajdonságait a hatóanyag
sajátságai és a polimer jellemzôi egyaránt
jelentôs értékben határozhatják meg.
A fenti példákban a polimer komponenst "szerencsésen"
kiválasztott polimer és ismert tumorgátló sajátságokkal
bíró hatóanyag-molekulák alkották. A
racionális polimer terapeutikumtervezés érdekében
fontos, hogy szisztematikus kísérletekkel feltárjuk
a polimer makromolekula kémiai szerkezete és a biológiai
hatása közötti összefüggéseket. Ezt követôen
válik lehetségessé a polimer komponens tulajdonságainak
optimalizálása, tervezett módon történô
kialakítása. A konjugátumokkal szerzett kedvezô
eredmények áttekintése arra is felhívja a figyelmet,
hogy az alkalmazott polimerek mindkét esetben a szervezetben
történõ lebomlásának részleges
vagy teljes hiánya korlátot szabhat e konjugátumokkal
végzett kezelések elterjedésének.
Az MTA-ELTE Peptidkémiai Kutatócsoportjában folyó kutatás célja olyan polimerek szintézise, amelyek a) képesek teljesen lebomlani a szervezetben, továbbá b) alkalmasak a kémiai szerkezet és a biológiai hatás közötti törvényszerûségek feltárására. Ezen megfontolások alapján esett a választás az elágazó láncú, polilizin gerincû polimer polipeptidekre, amelyeknek új családját állítottuk elõ (19-21 ).
Eágazó láncú polipeptidek
Sela és munkatársai a 60-as években írták
le elôször elágazó láncú polipeptidek
szintézisét (22). E vegyületek egyszerûsített
változatának kialakításával közel
50 tagú vegyületcsaládhoz jutottunk. Az oldalláncok
összetételének, az aminosavak konfigurációjának
módszeres változtatásával egymással
rokon, de kisebb-nagyobb mértékben eltérô szerkezettel
(pl. töltés) jellemezhetô polimer polipeptideket kaptunk
(1921). A fô típusokról a 4. ábra ad
áttekintést.
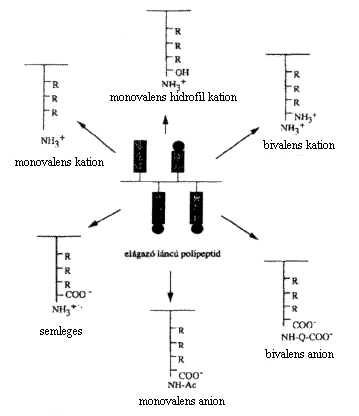
4. ábra. Elágazó láncú, polilizin gerincû, a szervezetben lebomlani képes polimer polipeptidek fô típusai
A primer szerkezet minden korábbinál pontosabb leírása során meghatároztuk az oldalláncok hosszúságeloszlását és enantiomer-összetételét, tisztáztuk e vegyületek aminosavsorrendje és oldatbeli térszerkezete között fennálló összefüggéseket. 1980-ban elsôként mutattuk ki, hogy az oldallánc felépítésének célszerû megválasztásával elôállítható fiziológiás körülmények között pozitív töltésû (kationos) variáns, illetve semleges karakterû rendezett vagy rendezetlen térszerkezetû polimer.
Állatkísérletekkel bizonyítottuk, hogy e polimerek vérkeringésbôl történô távozását, szervezetbeli eloszlását, sejttoxicitását töltésviszonyaik (pozitív/negatív, sûrûség) nagymértékben befolyásolják (23, 24). Az immunrendszerre való hatásuk tanulmányozása során rámutattunk arra, hogy az oldatbeli térszerkezet, valamint az oldallánc felépítése együttesen határozza meg a vegyületek által kiváltott immunreakció mértékét (20).
A hazai és nemzetközi tudományos egyûttmüködésben
feltárt összefüggések azt bizonyítják,
hogy a kémiai szerkezet (aminosavösszetétel és
sorrend, térszerkezet) átgondolt módosításával
elôállítható olyan polimer, amely a keringésben
hosszabb vagy rövidebb ideig van jelen. Sejtekre nem gyakorol toxikus
hatást, jelentôs immunreakciót nem vált ki.
Az eredmények arra utalnak, hogy a polimer sajátságainak
átgondolt tervezésével jelentôs mértékben
javítani lehet a biológiailag aktív kis molekulák
terápiás hatékonyságát.
Elágazó láncú polipeptíd - tumorellenes
szer konjugátumok szintézise és biológiai vizsgálata
Az elmúlt években kutatócsoportunk olyan konjugátumok
elôállítását tûzte ki célul,
amelyekben a szervezetben lebomlani képes polimerhez tumorellenes
szerek kapcsolódnak. E célból daunomicint [Dau] (25),
methotrexatot (26), bórszármazékokat (27) vagy GnRH-származékot
(28), újabban pedig a metasztázisképzõdésben
szerepet játszó enziminhibitorokat (amiloridot, amino-kapronsavat),
valamint radioaktív izotópokat (29) kapcsoltunk különbözô,
de szerkezetileg egymással rokonságban álló
elágazó láncú polipeptidekhez. E rövid
összefoglalóban a daunomicint tartalmazó konjugátumok
szintézisével és jellemzésével kapcsolatos
néhány eredményre kívánom felhívni
a figyelmet.
A daunomicint mellékhatásainak (pl. kardiotoxicitás) csökkentése érdekében többféle szintetikus polimerhez kapcsolták (30). Munkánk során két szempontot tartottunk szem elõtt. Az egyik az volt, hogy a daunomicin és a polimer között olyan kötést hozzunk létre, amely a véráramban stabil, ugyanakkor a célsejtben könnyen elhasad. Ennek elônye az, hogy a konjugátum bomlásakor a sejt belsejében szabadul fel a Dau, és a sejt elpusztul. Ugyanakkor a daunomicin "útközben" (a vérkeringésben) nem válik szabaddá, tehát nem juthat be "akármelyik" sejtbe (2. ábra). A másik szempont a kísérletek tervezésénél olyan polimerek kiválasztása volt, amelyek egymástól kismértékben különböznek csupán. Így, ha logikusan változtatjuk a polimerek felépítését, összefüggést találhatunk a polimer szerkezete és a konjugátum tumorellenes hatása között. Természetesen ennek elôfeltétele az, hogy a daunomicin és a polimer között mindig ugyanolyan kötést hozzunk létre. Polimerként olyan vegyületeket próbáltunk ki, amelyek oldalláncain különbözô típusú aminosavak voltak. Ez azt eredményezte, hogy többféle, pozitív töltéssel bíró (kationos polimer, ahol X = Leu, Phe, Pro stb.) vagy semleges (amfoter polimer, X = Glu) sajátságú konjugátumhoz jutottunk. Az általunk kidolgozott eljárással az oldalláncok 20-30%-ára lehetett daunomicint beépíteni (31).
A konjugátumok biológiai tulajdonságai közül megvizsgáltuk a csontszarkóma sejtkultúrákra gyakorolt citotoxicitását (25). Megállapítottuk, hogy a konjugátum képes a sejtek elpusztítására. Meg kell jegyezni azt is, hogy ez a hatás nem olyan mértékû; mint a "szabad" esetében. E vizsgálatsorozat azt is egyértelmûen kimutatta, hogy a konjugátumok toxicitásának mértéke jelentôsen függ az alkalmazott polimer polipeptid szerkezetétõl. Az amfoter, láncvégeken glutaminsavat tartalmazó cAD-EAK konjugátum sejtpusztító hatása jóval nagyobb, mint a kationos polimert magában foglaló konjugátumé. Ezek az adatok arra utalnak, hogy a polimer komponens oldallánc-felépítésének megváltoztatásával lehetôség van a konjugátum sejtpusztító tulajdonságának befolyásolására.
Egészséges egereken is végeztünk kísérleteket. Adaunomicinnel kezelt állatok a toxikus mellékhatások miatt 8 mg/kg testsúly dózis alkalmazása esetén elhullottak. Ugyanakkor a cAD-EAK konjugátummal kezelt egerek közûl még 30 mg/kg (daunomicin-tartalomra számított) adagolásakor sem történt pusztulás. A toxicitás-vizsgálatok kedvezô eredménnyel zárultak.
A terápiás alkalmazás szempontjából fontos szempont a konjugátumok szervezetbeni sorsának, biodisztribúctójának ismerete. Ezért radioaktív izotóppal jelzett konjugátumokkal elôször egészséges egereken végeztünk kísérleteket. Az intravénásan beadott cAD-polimer konjugátumok vérkeringésbeli jelenlétét, ennek kinetikáját, valamint a 24 óra utáni szerveloszlást vizsgáltuk. Megállapítottuk, hogy a polimer hordozó szerkezete jelentõs mértékben meghatározza a konjugátumok keringésbôl történô távozását (5. ábra). A kationos sajátságú hordozót tartalmazó származékok (pl. cAD-LAK) gyorsan távoznak a keringésbôl.
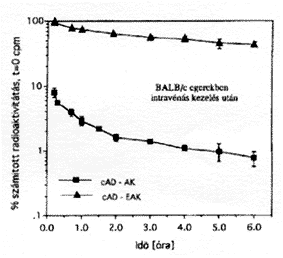
5. ábra. A polimer oldallánc-szerkezet jelentôsen befolyásolja a konjugátomok jelenlétét a vérkeringésben. EAK, oldallancvégeken Glu-t tartalmazó, amfoter polipeptid, AK, polikationos polipeptid, cAD, cisz-akonitil-daunomycin
Ezzel szemben az amfoter karakterû konjugátumok (pl. cAD-EAK) lényegesen hosszabb ideig maradnak a vérkeringésben. A vizsgálatok eredményei alapján arra a következtetésre jutottunk, hogy a polimer komponens és a konjugátum biodisztribúciós sajátságai között szoros a polimer töltésével összefüggô kapcsolat áll fenn (25).
A fenti kísérletek eredményei alapján választottuk ki az amfoter sajátságú cAD-EAK konjugátumot terápiás kísérletek céljára. Azt tanulmányoztuk, hogy a szabad daunomicinhez képest a konjugátum milyen tumorgátló sajátságokat mutat (32). Gaál Dezsô (Országos Onkológiai Intézet) közremûködésével elôször megállapítottuk, hogy az L1210 leukémiás egerek 5 mg/kg testsúly szabad daunomicin dózis alkalmazásakor 50%-kal éltek hosszabb ideig, mint a kezeletlen tumoros csoport egyedei (7 nap helyett 10 nap után pusztultak el) (6. ábra).
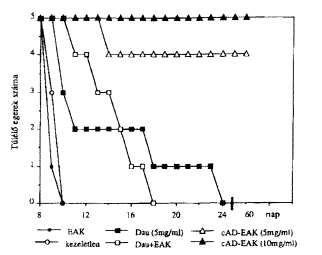
6. ábra. Daunomycin és daunomycin elágazó láncú pofipeptid (cAD-EAK) konjugátum hatása L1210 leukémiás egerek túlétésére egyetlen intravénás kezelés után
Ha cAD-EAK konjugátumból kaptak az egerek ugyanilyen dózist, az állatok 86%-a még 60 nap után is éltek. Mivel a konjugátumból nagyobb dózist is elviseltek az egerek, a kezelést 10 mg/kg egyszeri dózissal is elvégeztük. Ebben az esetben a teljes kezelt csoport megérte a 60. napot, azaz a kísérlet utolsó napját (32). A fenti eredményeket alátámasztják A. Fabra (University of Barcelona) megfigyelései egy másik, gyorsan metasztázist képezô carcinoma tumor esetében is (33).