![]()
1662-ben Boyle felfedezte, hogy konstans T hômérsékleten a gáz térfogata (V) fordítottan arányos a nyomásával (P). Késôbb Charles és Gay-Lussac úgy találták, hogy állandó nyomáson a gáz térfogata arányos a hômérséklettel. Ezt a két eredményt 1834-ben Clapeyron foglalta össze az ideális gáz elsô egyesített gáztörvényében:
PV=RT
ahol R az egyetemes gázállandó. (Itt és a késôbbiekben egy mól gázra vonatkoznak az egyenletek.) A kezdetektôl fogva világos volt azonban, hogy ez az egyenlet sokszor csak durván, sôt néha teljesen helytelenül képes leírni az anyagok viselkedését. Például a gázok folyadékká való kondenzációja egyáltalán nem írható le a segítségével. Van der Waals 1873-ban megjelent híres dolgozatában (On the continuity of the gas and the liquid state) vetette fel azt az ötletet, hogy a gázok és a folyadékok között nincs alapvetô különbség. Bevezetett egy állapotegyenletet, amely képes volt leírni mind a folyadék-, mind a gáz- (gôz-) fázist:
![]()
A két konstans (a és b) az adott anyagra jellemzô állandók, mégpedig az "a" a molekulák közötti erôket jellemzi, míg "b" a molekulák térfogatával függ össze. Ez az állapotegyenlet képes leírni a folyadék és gôzfázis egyensúlyát, valamint a kritikus állapotot.
A Van der Waals egyenlettel leírhatjuk a folyadék-gôz egyensúly összes fontos jellemzôjét. Azonban, mivel nem túl pontos, többen is igyekeztek javítani rajta. 1949-ben Redlich és Kwong fontos módosítást vezetett be. Az ô állapotegyenletük (RK):
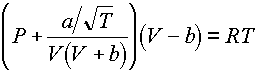
Jól látható, hogy a Van der Waals egyenletbôl ered, de sokkal pontosabban leírja a gázfázis viselkedését. 1972-ben Soave módosította az RK-egyenletet, amely azóta Soave-Redlich-Kwong (SRK) állapotegyenlet néven ismert:
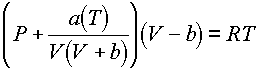
ahol a(T) hômérsékletfüggô mennyiség, amelynek segítségével pontosabban megjósolhatják a tiszta anyagok gôznyomását. Ez a változtatás igen fontosnak bizonyult a folyadék-gôz egyensúly számszerû leírásában. Négy évvel késôbb, 1976-ban, Peng és Robinson kidolgozták a köbös állapotegyenletet. Ez az egyenlet a folyadékok sûrûségének jobb leírását tette lehetôvé:
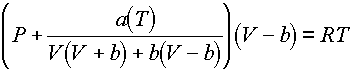
ahol a(T) hômérsékletfüggô mennyiség (akárcsak az SRK-állapotegyenletben).
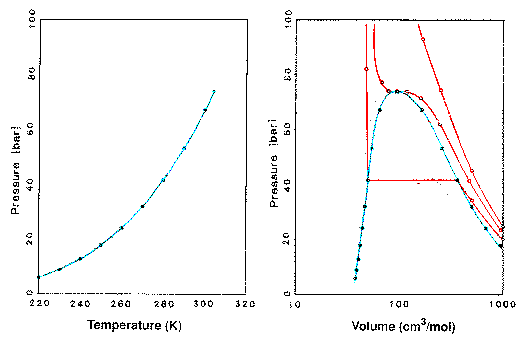
A szén-dioxid kísérleti pT és pV diagramja. A pT vonal (gôznyomás) a kritikus pontban ér véget (Tc=304,21 K, Pc=73,82 bar). A PV diagramon három izoterma látható (piros vonalak; a hozzájuk tartozó hômérséklet: 280 K, 304,21 K – azaz a kritikus hômérséklet – és 330 K. A kék vonal alatti területen alakul ki a folyadék-gôz egyensúly.
Az amszterdami Shell Research and Technology Centerben kidolgoztak egy új állapotegyenletet (CUBIC-4G), ami hitük szerint ebben az évtizedben minden fázisegyensúly-számítással kapcsolatos igényt kielégít:
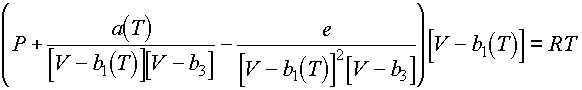
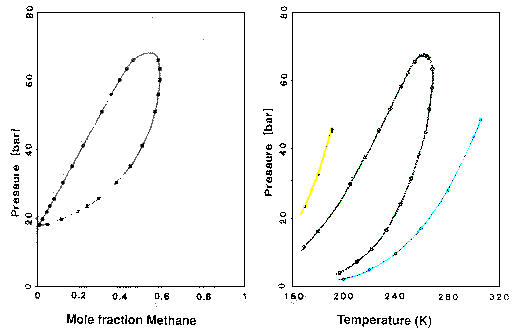
A metán-etán keverék kísérleti px és pT diagramja. A px diagram a 260 K-es állapotot ábrázolja. A pT diagramon a tiszta metán (sárga), egy ekvimoláris metán-etán keverék (zöld) és a tiszta etán (kék) látható.
Ahhoz, hogy az állapotegyenletet keverékekre is használhassuk, meg kell adni, hogyan számíthatók ki a paraméterek a tiszta anyagok paraméterei és a koncentráció ismeretében. Az ilyen elôírásokat "keverési szabályoknak" nevezik. Kétkomponensû keverékekre mi az alábbi keverési szabályt használjuk:
![]()
![]()
Következô: A fázisegyensúly szimulációja