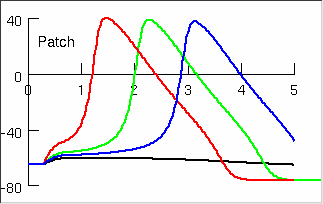
 2.1. ábra: Az akciós potenciál mint küszöbjelenség.
Fekete vonal: küszöb alatti ingerre adott válasz. Kék,
zöld, piros vonal: egyre nagyobb, küszöb feletti ingerekre
adott válasz. (A NEURON programcsomag
demonstrációs ábrája.)
2.1. ábra: Az akciós potenciál mint küszöbjelenség.
Fekete vonal: küszöb alatti ingerre adott válasz. Kék,
zöld, piros vonal: egyre nagyobb, küszöb feletti ingerekre
adott válasz. (A NEURON programcsomag
demonstrációs ábrája.)Századunk 50-es éveiben több okból is megnõtt az igény arra, hogy az elméleti biológusok a biológiailag reális neuron-modellek létrehozásához új fogalmi keretet hozzanak létre, és új modellezési stratégiát kövessenek.
A MCP hálózatok több
bemenetû (xi, i=1,...,n) és egykimenetû
(y) bináris küszöbelemekbõl állnak.
A hálózat egy elemének mûködését
meghatározó szabály szerint y=1, ha a bemenetek
kapcsolaterõsségekkel súlyozott összege egy küszöbnél
nagyobb, és y=0 egyébként. Ilyen szabály
írja le a hálózat minden egyes elemének mûködését.
A rendszer állapotát egy rögzített idõpontban
egy nullákból és egyesekbõl álló
sorozat írja le. A sorozat éppen annyi elemû, ahány
neuron alkotja a hálózatot. Külön választás
tárgya, hogy egy idõegység alatt a hálózat
egyetlen vagy összes eleme módosuljon-e ("aszinkron"
vagy "szinkron" feldolgozás).
Összefoglalva tehát azt lehetne mondani, hogy a MCP modell úgy fél évszázada még reálisnak tûnhetett, az ismeretek gazdagodásával azonban a matematikai modellezés új generációja lépett fel, és ezen szemszögbõl egyértelmû, hogy minden, a neuront mint kétállapotú rendszert leíró modell az egyszerûség csábításának enged - immár indokolatlanul. Egy idegsejt is bonyolult, de nem reménytelenül, mert létezik olyan kidolgozott modell-keret, amelybe (majdnem) minden releváns ismeret belefoglalható. A neuron anatómiáját és fiziológiáját szinte tetszõleges igénnyel lehet a modellekben figyelembe venni, és a részletekbe merülésnek csak az ésszerûség szab határt.
Minden élõ sejtre igaz az, hogy a sejthártyájának (membránjának) két oldala között elektromos potenciálkülönbség áll fenn, amely ingermentes állapotban körülbelül -80 mV nagyságú. Ezt nevezzük nyugalmi potenciálnak, melynek kialakulását a membrán különbözõ ionokra vonatkozó szelektív permeabilitása teszi lehetõvé. A nyugalmi membránpotenciál fenntartása energiaigényes folyamat, ionpumpák mûködése által jön létre. A membrán szelektív permeabilitásának és az ionpumpáknak hatására a sejt belsejében magasabb kálium-koncentráció, míg kívül, az extracelluláris térben magasabb nátrium- és kalcium-koncentráció alakul ki.
Ha a membránpotenciál valamely ingerületi folyamat hatására megváltozik, akkor a sejthártya permeabilitása is megváltozik a különbözõ ionokra nézve, ioncsatornák nyílnak meg, vagy csukódnak be, és ionáramlás kezdõdik a sejt belseje és a külsõ tér között. Az ionáramokat két alapvetõ csoportra oszthatjuk: passzív és aktív áramokra. A membrán passzív áramokat létrehozó passzív áramvezetõ-képessége az idõtõl és a feszültségtõl független. Az aktív áramok leírásában szereplõ vezetõképességek viszont mind az idõ, mind pedig a membránpotenciál függvényei. Az idõfüggés az adott ionra szelektív ioncsatorna "kapuzási" (nyitási-csukási) folyamatainak sebességét írja le, míg a feszültségfüggés azt adja meg, hogy az ioncsatorna egy adott membránpotenciál-értéknél milyen valószínûséggel van nyitva.
 2.1. ábra: Az akciós potenciál mint küszöbjelenség.
Fekete vonal: küszöb alatti ingerre adott válasz. Kék,
zöld, piros vonal: egyre nagyobb, küszöb feletti ingerekre
adott válasz. (A NEURON programcsomag
demonstrációs ábrája.)
2.1. ábra: Az akciós potenciál mint küszöbjelenség.
Fekete vonal: küszöb alatti ingerre adott válasz. Kék,
zöld, piros vonal: egyre nagyobb, küszöb feletti ingerekre
adott válasz. (A NEURON programcsomag
demonstrációs ábrája.)
Ha a membránpotenciál értéke elér egy küszöböt, a nátrium-csatornák hirtelen nyitott állapotba kerülnek, és a nátrium beáramlása következtében a külsõ és a belsõ oldal közötti potenciálkülönbség ugrásszerûen megnõ, legtöbbször pozitív értéket vesz fel (2.1. ábra). Ilyenkor mondjuk, hogy a sejt tüzel, vagyis akciós potenciál keletkezik, amely az idegsejt axonján végigterjedve jut el az axonvégzõdésekig, ahol neurotranszmitterek felszabadulását váltja ki. A neurotranszmitterek a szinaptikus kapcsolatokon keresztül a posztszinaptikus sejtmembránhoz eljutva, annak két oldala közötti potenciálkülönbségben változást idéznek elõ, és így jön létre az ingerületátvitel neuronról neuronra.
Több próbálkozás, modell-kísérlet született az idegsejt dinamikájának leírására, de a legeredményesebbnek, a leginkább továbbfejleszthetõ elméletnek a Hodgkin és Huxley 1952-es munkájában összefoglalt formalizmus bizonyult. Õk a modern kísérleti technikákat a kvantitatív jellemzés igényével kapcsolták össze, és a tintahal axonjában generált akciós potenciál leírására alkottak modellt. Hodgkin és Huxley feltételezése az volt, hogy az ideg-membrán jellegzetes, inger hatására bekövetkezõ feszültségváltozását, az akciós potenciált ionáramok segítségével lehet leírni (szemben az akkor még elevenen létezõ elektron-elmélettel). Az aktív csatornák feszültségfüggésének mérése és kvantitatív leírása jelentette a legjelentõsebb eredményt. Ehhez a membrán adott ionra vonatkozó vezetõképességét a maximális vezetõképesség és a feszültségfüggõ nyitási valószínûség szorzatára bontották fel. Ezt a feszültségfüggést Hodgkin és Huxley az ún. feszültségzár (voltage clamp) kísérleti technika alkalmazásával mérte. Hipotézisük az volt, hogy az ioncsatornák nyitását és csukását a kémiai reakciók kinetikájának mintájára lehet leírni. Hodgkin és Huxley eredményei a következõ, a feszültségváltozásra, ill. az ionáramokra vonatkozó közönséges differenciálegyenlet-rendszer segítségével foglalhatók össze:
(2.1)
C · dV/dt = INa + IK + Il
ahol C a membrán elektromos kapacitása és I jelöli az aktív nátrium és kálium, illetve a passzív szivárgási áramot:
(2.2) INa=gNamax
· m3 · h · (V-ENa)
(2.3) IK=gKmax
· n4 · (V-EK)
(2.4) Il=gl
· (V-El)
Itt gmax az egyes csatornákhoz tartozó maximális vezetõképesség, E az egyes ionáramokra jellemzõ egyensúlyi potenciál, m, h és n pedig az adott csatorna kapuzó változói, amelyekre egyenként a következõ differenciálegyenlet vonatkozik:
(2.5) dx/dt
= Ax(V) · x + Bx(V) · (1-x)
x = m, h, n
Hodgkin és Huxley kutatásainak leglényegesebb és legnehezebb része az ioncsatornák kinetikájának leírása (2.5) volt. Munkájukat siker koronázta, és a tintahal axonjából kiváltott akciós potenciál alakját egyenleteik segítségével számítógépes szimulációkkal reprodukálták (2.2. ábra).
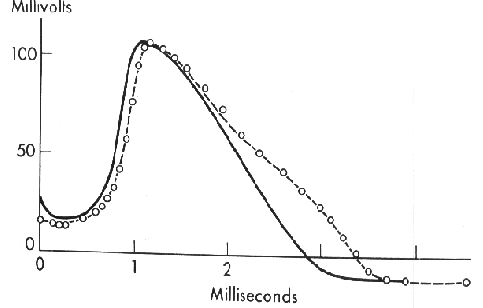 2.2. ábra: Az akciós potenciál alakja Hodgkin és
Huxley modelljében (körök) és a valódi axonban
(folytonos vonal). (K.S.
Cole ábrája)
2.2. ábra: Az akciós potenciál alakja Hodgkin és
Huxley modelljében (körök) és a valódi axonban
(folytonos vonal). (K.S.
Cole ábrája)
Modelljük alapfeltevései rendkívül hatékonynak bizonyultak, így a Nobel-díjjal jutalmazott két kutató életmûve az elméleti idegtudomány klasszikusává vált. (Bõvebben lásd J. W. Moore: A Brief history of Computational Neuroscience - From my perspective.)
Egyetlen idegsejt dinamikájának vizsgálata két fõ irányból kapott ösztönzést és segítette elõ biológiailag reális modellek létrehozását. Mint ahogy említettük már, az utóbbi néhány évtizedben az idegrendszeri kutatások jelentõs eredményeket mutattak fel mind az anatómiai, mind pedig az elektrofiziológiai módszerek fejlõdésének következtében, és ezen kutatások eredményeképpen ismertté váltak a neuronok nyúlványainak bonyolult elágazási mintázatai, illetve a különféle típusú neuronok fiziológiai tulajdonságai. Másfelõl, a formális modellek a dinamikus rendszerek elmélete szempontjából fontos jelenségek, mint például oszcilláció, "burst", káosz bemutatására váltak képessé.
A Hodgkin-Huxley modell rendkívül alkalmasnak mutatkozott arra, hogy a kísérleti munkák során felhalmozott ismeretek figyelembe vételével bõvíthetõ legyen, így számos továbbfejlesztett változatát lelhetjük fel a szakirodalomban.
Mivel az eredeti modell csak az axonra vonatkozott, nem számolt az idegsejt morfológiájával, holott egyre több, nagy jelentõséggel bíró részletre derült fény a neuroanatómusok kutatásainak köszönhetõen. Ugyancsak az idegsejt térbeli kiterjedésének figyelembe vételére sarkallt az az igény, hogy az ingerület terjedését is írjuk le. Ezen feladatok megoldására a modellezõk a következõ, kábelegyenletnek nevezett, parciális differenciálegyenletet vezették be a feszültség térbeli változásának kifejezésére:
(2.6) T · Vt = L2 · Vxx + R · (Iionic + Iext + Isyn)
ahol T a membrán idõállandója, amely a membrán elektromos kapacitásától és a membrán keresztirányú R ellenállásától függ; L a membránt jellemzõ karakterisztikus hossz, amely a membrán hosszanti és keresztirányú ellenállásának, valamint a kábel keresztmetszetének függvénye; Iionic a különféle egyedi, aktív ionáramok összegzése; Isyn pedig a szinaptikus ingerületátvitel hatására keletkezõ szinaptikus áram.
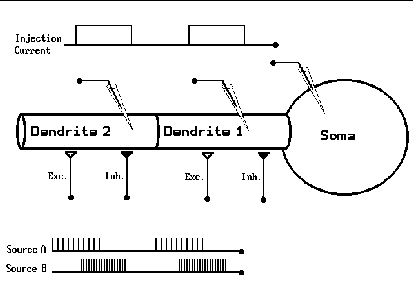 2.3. ábra: Az idegsejt rekesz-modellje (a GENESIS
programcsomag demonstrációs ábrája).
2.3. ábra: Az idegsejt rekesz-modellje (a GENESIS
programcsomag demonstrációs ábrája).
Az idegsejtet a neuroanatómus által készített morfológiai ábra és a fiziólógus mérései alapján felosztjuk néhány henger, kúp, vagy gömb alakú rekeszre (compartment) olymódon, hogy (1) a rekeszek méretei megegyezzenek a modellezett neuron egyes darabjainak méreteivel, (2) egy rekeszen belül az ioncsatornák sûrûségét azonosnak választjuk, de ez az érték rekeszenként változhat. Így vesszük figyelembe azt, hogy a neuron axonján, dendritjein, vagy a sejttestten illetve ezek egy-egy darabkáján más-más csatornasûrûség jellemzõ. Az egyes rekeszeket az anatómiai ábra szerint illesztjük össze, figyelembe véve a neuron axon- és dendritelágazódásainak pontos helyét. A membránpotenciál kiszámításához a rekeszeket további kisebb részekre, ún. szegmensekre oszthatjuk fel. Azt feltételezzük, hogy a potenciál értéke egyetlen szegmensen belül nem függ a helytõl, így a parciális differenciálegyenlet helyett - egyetlen szegmensre - közönséges differenciálegyenletet kell megoldani. Összesen annyi helyen számoljuk ki a membránpotenciált, ahány szegmensre osztottuk fel a neuront.
Elektrofiziológiai mérések szimulációs kísérletekkel történõ reprodukálására az inger paramétereinek (pl. amplitudó, idõtartam, hely) és a mérés helyének megadásával van lehetõség. Számos neurobiológiai kutatás azt vizsgálja, hogy milyen hatása van a neuron mûködésére valamely ioncsatorna részleges vagy teljes blokkolásának. Ennek szimulációja az adott ioncsatorna-típushoz tartozó vezetõképesség csökkentésével történik. A modellezés nagy elõnye az, hogy tetszés szerinti, tehát kísérleti úton nehezen, vagy egyáltalán nem megvalósítható körülmények között is vizsgálható egy neuron, így elõrejelzések, alternatív magyarázatok adhatóak az elemi idegmûködésre, ami kijelölheti a kísérletezõ további kutatásainak irányát is.
Ma két, széles körben elterjedt szimulációs programcsomag létezik, amelyek a fentiekben leírt modellkeretet valósítják meg: a NEURON (Hines 1993) és a GENESIS (Bower and Beeman 1995). Kutatócsoportunkban a bulbus olfactorius és a hippocampus különféle neuron-típusainak részletes egysejt-modelljei, valamint e részletes egysejt-modellekbõl felépített hálózatok elkészítésén dolgozunk a fenti programcsomagok felhasználásával (Aradi és Érdi 1996).
A modell-idegsejtek összekapcsolása neuronhálózatokká szintén követni képes a reális idegrendszeri hálózati struktúrák tulajdonságait, valamint a szinaptikus kapcsolatok fiziológiai jellemzõit. A jelen modellkereten belül pontosan megadható, hogy a preszinaptikus és a posztszinaptikus sejt mely pontján helyezkedik el a szinapszis, és hogy milyen neurofiziológiából ismert kvantitatív paraméterek (pl. szinapsziserõsség, a szinaptikus ingerületáttevõdés idõbeli lefutása) jellemzik (3. fejezet).
Tartalom | Elôzô fejezet } Következô fejezet
Please send your comments to grobler@sunserv.kfki.hu.