Elektrokémiai cellák és reakciók
Azt vizsgáljuk, milyen fizikai és kémiai paraméterek befolyásolják azokat a töltésátlépési folyamatokat, amelyek két kémiailag különbözô fázis határfelületén zajlanak. A két fázis egyike csaknem mindig elektrolit: ebben az áramot ionok vezetik. Elektrolit lehet vizes vagy nemvizes oldat, lehet sóolvadék, esetleg ionvezetô szilárdtest (például Na-b -alumina, ahol az áramot a mozgékony nátriumionok szállítják). A másik fázist elektródnak nevezzük: ebben elektronvezetés zajlik. Az elektród lehet fém vagy félvezetô, folyékony vagy szilárd halmazállapotú.
Kézenfekvô lenne egyetlen határfelületet tanulmányozni, de kísérletileg ez kivihetetlen. A gyakorlatban mindig elektrokémiai cellával van dolgunk: ez rendszerint legalább két elektródból és egy elektrolitból áll.
A cella két elektródja között – akár folyik áram a cellán át, akár nem – rendszerint potenciálkülönbség mérhetô: ez az érték az áram útjába esô fázisok között fennálló potenciálkülönbségek eredôje. Jól vezetô fázisok belsejében a potenciál gyakorlatilag állandó – a változás a határfelületek közvetlen közelében, a határrétegben történik. Itt emiatt rendkívül nagy az elektromos térerôsség, ezért ez várhatóan erôsen befolyásolja a töltéssel rendelkezô reakciópartnerek (ionok vagy elektronok) kémiai reakcióit. A cellapotenciál mérése és szabályozása ezért az elektródkinetika gyakorlatának egyik legfontosabb eleme.
Az elektrokémiai cella felépítését az alábbi módon adjuk meg:
![]()
A törtvonal a fázishatárokat jelöli, az azonos fázisban található ionokat pedig vesszôvel választjuk el egymástól. A gázfázisú komponenest (ha van ilyen) a megfelelô vezetô fázis mellé írjuk:
![]()
Az elektrokémiai cella két félcellából áll: ezekben térben elválasztott, egymástól független kémiai reakciók zajlanak. Mindkét reakciót befolyásolják a megfelelô elektródon fennálló potenciálviszonyok, ezeket azonban külön-külön nem tudjuk szabályozni. Az esetek túlnyomó többségében csak a reakciók egyikét kívánjuk vizsgálni: azt, amely a munka- vagy indikátorelektródon zajlik. Hogy ezt megtehessük, a másik elektródot "szaványosítjuk" oly módon, hogy az itteni fázisok kémiai összetétele állandó legyen: ez a referenciaelektród.
A nemzetközileg elfogadott elsôdleges referencia a normál hidrogénelektród, amelyben valamennyi komponens aktivitása egységnyi:
![]() vizes
oldatban)
vizes
oldatban)
A kísérleti szempontból kényelmetlen hidrogénelektród helyett a gyakorlatban többféle másodlagos referenciát használnak: ezek között a telített kalomelelektród a legelterjedtebb:
![]() (telített vizes oldat)
(telített vizes oldat)
A telített kalomel potenciálja 0,242 V a hidrogénelektródhoz képest.
Mivel a referenciaelektródok összetétele állandó, potenciáljuk rögzített érték. A cellában lejátszódó változásokat tehát a munkaelektródon zajló folyamatoknak tulajdoníthatjuk. Amikor azt mondjuk, hogy mérjük vagy beállítjuk a munkaelektród potenciálját a referenciához képest, akkor tulajdonképpen a munkaelektród elektronjainak energiáját mérjük vagy szabályozzuk.
Ha a munkaelektród potenciálját a negatívabb értékek felé toljuk el, nô az elektronok energiája, és elôbb-utóbb elér egy olyan értéket, amely lehetôvé teszi az elelktron átlépését az elektrolit valamelyik alkotórészének betöltetlen elektronállapotába. Ilyenkor redukciós áramról beszélünk (1. ábra). Hasonló módon, az elektron energiáját – a potenciál pozitív irányú mozgatásával – lecsökkenthetjük, és így elérhetjük azt az állapotot, amikor az elektrolit valamelyik részecskéjéhez tartozó elektron számára energetikailag kedvezôbb állapotot talál az elektródon, ezért átugrik oda. Ilyenkor oxidációs áramról beszélünk. Az oxidációs és a redukciós tartomány határát a rendszert felépítô kémiai komponensek által meghatározott E0 standard potenciál alapján húzhatjuk meg. Lássunk erre egy példát.
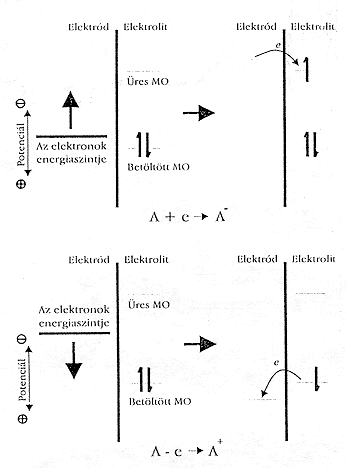
1. ábra
Merüljön Pt-elektród 0,01 M Fe3+-t, Sn4+-t és Ni2+-t tartalmazó 1 M sósavas oldatba. Azt várjuk, hogy elôször a ferriionok redukálódnak, mert a Fe3+/Fe2+redoxpár E0 értéke a legpozitívabb (azaz a Fe3+-t a legkönnyebb redukálni). A kísérleti tapasztalat igazolja várakozásunkat. Emlékeztetünk azonban arra, hogy E0 termodinamikai mennyiség. Tudjuk, hogy az egyensúlyi termodinamika csak a folyamatok lehetséges irányát adja meg, de nem mond semmit ezek sebességérôl – csak szükséges, de nem elegendô feltételt fogalmaz meg. Lássunk erre egy példát.
Vegyünk ugyancsak mólos sósavoldatba
merülô Hg-elektródot, és legyen az elektrolitban
oldva 0,01 M Cr3+ és Zn2+ is.
A termodinamika tanítása szerint most (egyre negatívabb
potenciálok felé haladva) elôször a 2H++2e®
H2 reakciónak
kellene lejátszódnia, és ezt követné a
Cr3+ redukciója. A valóságban azonban
az utóbbi az elsô megfigyelhetô reakció, mert
a hidrogénfejlôdés a Hg-elektródon rendkívül
lassú. Alapvetô fontosságú tehát, hogy
a folyamatok termodinamikáján kívül foglalkozzunk
azok sebességi viszonyaival is: ezzel a reakciókinetika
foglalkozik.