![]() (1)
(1)
2. Galvánelemek
Cinkdarabkát réz(II)-szulfát oldatba dobva azt figyelhetjük meg, hogy annak felülete barnásvörössé válik, mert felületére réz cementálódik ki. A folyamatot a
![]() (1)
(1)
reakcióegyenlet írja le.
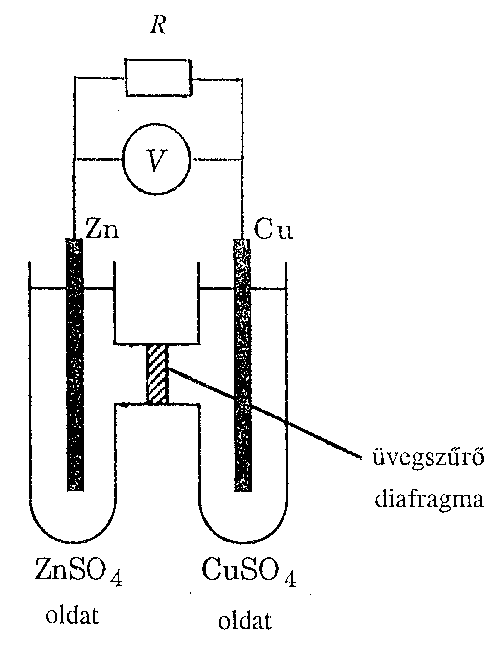
A réz redukciója és a cink oxidációja térben szétválasztható, ha a baloldai ábrán vázolt galvánelemet (Daniell-elemet) elkészítjük. A két fém a megfelelô szulfátoldatokba merül, melyek egymással ugyan érintkeznek, de nem keveredhetnek. Az egyes fémeket, a velük érinkezô oldattal együtt elektródnak nevezzük. Kísérletekben az elektródokat vagy másként: a két félcellát általában porózus szigetelôvel, diafragmával választjuk el. Elvileg az érintkezési felületen csak a szulfát ionok léphetnek át - e feltételt az ún. féligáteresztô membránok elégítik ki. Formálisan ezt a galvánelemet a következôként szokás jelölni (figyelembe véve azt is, hogy a feszültségmérô mindig két azonos fém közötti potenciálkülönbséget mér):
![]() (2)
(2)
Itt | fázishatárokat jelöl,
|| pedig a két oldat közötti membránt.
Hacsak a külsô R ellenállás nem zérus (nem rövidzár), a V feszültségmérô valamekkora, nem zérus U feszültséget jelez: ezt nevezzük a galvánelem kapocsfeszültségének. Ha a külsô terhelés elhanyagolható (mind R, mind pedig a feszültségmérô belsô ellenállása is elegendôen nagy) és a galvánelem minden része egyensúlyban van, akkor a feszültségmérôn mérhetô feszültséget az elem elektromotoros erejének nevezzük, melynek jelölése a továbbiakban D E.
Amennyiben a külsô körön elektromos áram folyhat, a cink oxidálódik, (Zn® Zn2+), a rézionok a rézelektródra kiválva redukálódnak (Cu2+® Cu), és a szulfátionok a rézszulfát oldatból a cinkszulfát oldatba lépnek át. A teljes cella kémiai változásait az 1. reakcióegyenlet adja meg.
Ha a külsô körön elektromos
áram nem folyik, mindkét elektródon egyensúly
alakul ki (![]() ill.
ill. ![]() );
ilyenkor a teljes cellára a
);
ilyenkor a teljes cellára a ![]() egyensúly
jellemzô.
egyensúly
jellemzô.
Az elektrokémiában elôforduló potenciálok eredetével kapcsolatban néhány gondolatmenetet mutatunk be. Az elsô mutatja meg, hogy mi a kapcsolat a teljes cellában lezajló reakció szabadentalpiaváltozása és a cella elektromotoros ereje között, a másodikban és harmadikban pedig fémelektródokból illetve redoxelektródokból felépített galvánelem elektromotoros erejét számítjuk ki. Ezen levezetések alapján definiáljuk az elektródpotenciál majd a redoxpotenciál fogalmát.