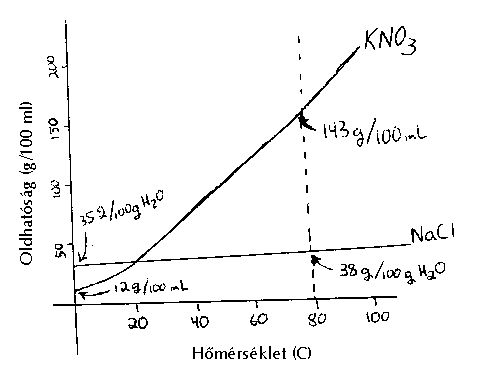
A kálium-nitrát és a nátrium-klorid oldhatósági görbéi

A kálium-nitrát és a nátrium-klorid oldhatósági görbéi
A Hány százalék só válik ki, ha egy 80 oC-os telített kálium-nitrát oldatot 0 oC-ra hűtünk?
A
Megoldás: 80 oC-on 143 g KNO3 oldódik 100 ml vízben, 0 oC-on 12 g.
Tehát 131 g só válik ki, ez az oldott só (131/143)100 = 91,6%-a
B 100 ml vízben 20 g KNO3-ot és 20 g NaCl-ot oldottunk fel.
Mennyi KNO3 és mennyi NaCl csapódik ki, ha a víz térfogatát (párologtatással) 100-ról 25 ml-re csökkentettük, miközben a hômérsékletet változatlanul 80 oC-on tartottuk?
B
Megoldás: 80 oC-on 143 g KNO3 oldódik 100 ml vízben, tehát 36 g oldódik 25 ml-ben.
Mivel csak 20 g KNO3 volt kezdetben, a teljes mennyiség oldatban marad, ha a víz térfogata 25 ml-re csökken, vagyis nem válik ki KNO3.
80 oC-on 38 g NaCl oldódik 100 ml vízben, tehát 9,5 g oldódik 25 ml-ben.
Mivel kezdetben 20 g NaCl volt, és csak 9,5 g maradhat oldatban, 10,5 g NaCl kiválik.
C Ugyanaz, mint a B kérdés, de mindkét sóból 10 g-ot oldunk fel 100 ml vízben, és a hômérsékletet 0 oC-ra csökkentjük.
Melyik só oldódik kevésbé, tehát melyik válik ki elôször?
C1 Megoldás: A KNO3 oldódik kevésbé, ezért ez válik ki elôször.
Mennyi KNO3 és mennyi NaCl csapódik ki?
C2 Megoldás:
0 oC-on 12 g KNO3 oldódik 100 ml vízben, tehát 3 g oldódik 25 ml-ben.
Mivel 10 g KNO3 volt kezdetben, 7 g kiválik.
0 oC-on 35 g NaCl oldódik 100 ml vízben, tehát 8,8 g oldódik 25 ml-ben.
Mivel 10 g NaCl volt kezdetben, és csak 8,8 g oldódik 0 oC-on, 1,2 g NaCl kicsapódik.
D Frakcionális kristályosításkor a szennyezett anyagot magas hômérsékleten oldják, majd a hômérsékletet csökkentik. A tisztítandó anyag kiválik, a szennyezések oldatban maradnak. (Szerencsés esetben.??)
D Megoldás: Mivel a KNO3 magas hômérsékleten jobban oldódik, mint a NaCl, alacsony hômérsékleten pedig kevésbé jól oldódik a NaCl-nál, ezért a keveréket célszerű meleg oldószerben feloldani, majd lehűteni, hogy a KNO3 kiváljon, és a NaCl oldatban maradjon.
Az A feladat eredményei azt mutatják, hogy a KNO3 nem fog teljesen kicsapódni, tehát egynél több lépésre van szükség. Másrészt, minél több oldószert (vizet) használunk, annál több KNO3 marad oldatban a hűtési lépés után. Ezért minél kevesebb meleg oldószerrel érdemes dolgozni.
1. lépés Oldjuk fel a keveréket kb. 35 ml 80 oC-os vízben.
Azért vegyünk 35 ml-t, mert:
(100 ml H2O / 143 g KNO3) · 45 g KNO3 = kb. 32 ml H2O
2. lépés Hűtsük le a keveréket 0 oC-ra.
Ezen a hômérsékleten az összes NaCl oldatban marad, mert 0 oC-on a NaCl oldhatósága 35g/100 ml H2O, és
(35 g NaCl / 100 ml H2O) · 35 ml H2O = 12,3 g NaCl
Ezen a hômérsékleten a KNO3 oldhatósága 12 g/100 ml H2O, ezért 4,2 g KNO3 oldva marad, míg 40,8 g kiválik.
(12 g KNO3 / 100 ml H2O) · 35 ml H2O = 4,2 g KNO3
3. lépés Szűrjük le a 40,8 g szilárd KNO3-ot. Most 5 g NaCl és 4,2 g KNO3 van 35 ml vízben. (Ha egy csepp oldat sem ment kárba...)
4. lépés Mivel 15 ml-nél több vizet használunk, a NaCl 0 oC-on oldatban marad.
(100 ml H2O / 35 g NaCl) · 5 g = 14,3 ml H2O
Csökkentsük a víz mennyiségét forralással 15 ml-re, majd az oldatot hűtsük le 0 oC-ra. Újabb 2,4 g KNO3 válik ki.
Oldatban marad: (12 g KNO3 / 100 m H2O) · 15 ml H2O = 1,8 g KNO3
A 2,4 g KNO3-ot megint le lehet szűrni. Ezzel összesen 43,2 g tiszta KNO3-ot kapunk.
(A lépések ismétlésével még sikerülne néhány tized gramm KNO3-ot kinyerni, de két kristályosítás után is visszakaptuk a KNO3 96%-át.)