15. fejezet - Aminosavak és fehérjék
Aminosavak
- a természetes aminosavak L sztereokémiájúak
és alfa-NH2-t tartalmaznak:
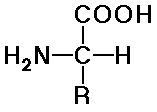
- szerkezetük az R csoportban különbözik
20 természetes aminosavat ismerünk
10 (esszenciális) aminosavat a táplálékkal
veszünk magunkhoz
(a többit képesek vagyunk szintetizálni)
Az oldallánc
- igen sokféle funkciós csoport és tulajdonság
- a glicinnek nincs oldallánca
- egyszerû alkil (apoláris) oldallánc
| |
|
R= |
| Ala |
alanin |
CH3 |
| Val |
valin |
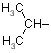 |
| Leu |
leucin |
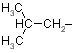 |
| Ile |
izoleucin |
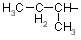 |
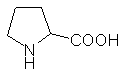
- Gyûrûs oldallánc (szekunder amin)
| Pro |
prolin |
 |
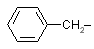
| Phe |
fenil-alanin |
 |
| Tyr |
tirozin |
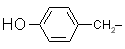 |
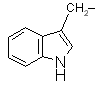
| Trp |
triptofán |
 |
| Ser |
szerin |
HO–CH2– |
| Thr |
treonin |
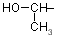 |
(vegyük észre, hogy a tirozin egyben fenol is)
| Cys |
cisztein |
HS–CH2– |
| Met |
metionin |
CH3–S–CH2–CH2– |
| Asp |
aszparaginsav |
HOOC–CH2– |
| Glu |
glutaminsav |
HOOC–CH2–CH2– |
- amid oldallánc (a fenti savakból)
| Asn |
aszparagin |
H2NOC–CH2– |
| Gln |
glutamin |
H2NOC–CH2–CH2– |
| Lys |
lizin |
H2N–(CH2)4– |
| Arg |
arginin |
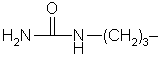 |
| His |
hisztidin |
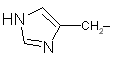 |
Aminosavak 3D modelljei
Az aminosavak sav-bázis tulajdonságai
- a bázikus amino- és a savas karboxilcsoport vizes oldatban
a biológiai pH körül ionizált formában van
- az alfa-amino-csoport pKa-ja kb. 9-10
- a karboxilcsoport pK-ja kb. 2-3
- pH ~ 2 alatt fõként kation (ammóniumion) forma
- pH ~ 2 - 10 között többnyire kettõs ionos forma
(ammónium kation és karboxil anion)
- pH ~ 10 fölött többnyire anionos forma (karboxilát
anion)
- az ionizálható oldallánccal rendelkezõ
aminosavak komplikáltabban viselkednek
Az izoelektromos pont
- az a pH, ahol a molekula fõként semleges formában
van
(és egyenlõ kis mennyiségben jelen van a kationos
és anionos forma is)
- a legtöbb aminosav izoelektromos pontja pKa értékeik
között van
- az ionizálható oldalláncú aminosavak izoelektromos
pontja magasabb pH-jú (bázikus oldallánc) vagy alacsonyabb
pH-jú (savas oldallánc)
Elektroforézis
- az aminosavak elválaszthatók oldatban, töltésük
alapján egy adott pH-n
pl. pH 7-nél az alanin közel semleges, az arginin többnyire
+, a glutaminsav többnyire -
- töltésüktõl függõen a molekulák
vagy a negatív, vagy a pozitív elektróda felé
vándorolnak (nedves gélen vagy papíron keresztül)
Peptidek - amidkötéssel összekapcsolt aminosavak
- az elnevezés az N-terminális (szabad amin) felõl
a C-terminális (szabad karboxil) felé
- az aminosavak -in végzõdését az utolsó
kivételével -ilre cseréljük
pl. a treonil-valin dipeptid
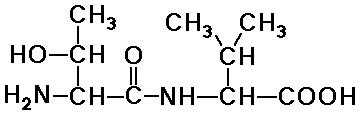
Thr-Val (treonil-valin)
- a valin-treonin más dipeptid lenne
Polipeptidek
- a peptideket 3-betûs (néha 1-betûs) kóddal
jelölik
- a polipeptidek variációja óriási, a 20
aminosavat használva
20 aminosav
400 dipeptid
8,000 tripeptid
160,000 tetrapeptid építhetõ
- egy tipikus fehárje 100 vagy több aminosavból áll,
így a variációk száma hatalmas
- a peptidek rendelkeznek az életfolyamatokhoz szükséges
összes tulajdonsággal
Aminosav maradék
- az aminosav maradék egy vízmolekulával kevesebb
az aminosavnál
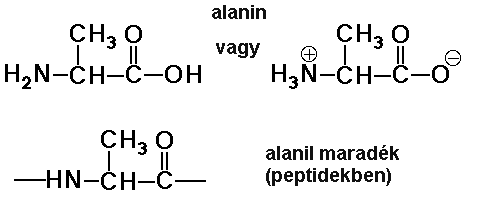
Diszulfid kapcsolódás
- a cisztein szívesen kapcsolódik S-S kötéssel
egy másik ciszteinnel

- a diszulfid hidak összekapcsolhatnak olyan peptidláncokat
is, melyek távol vannak a peptid szekvenciában
Aminosav analízis
- primer szerkezet - az aminosavak sorrendje a peptidláncban
- a teljes hidrolízis (huzamosabb hevítés vizes
sósavban) felhasítja az amidkötéseket és
felszabadítja az összes aminosavat
- az aminosavak egyenként elválaszthatók elektroforézissel
vagy kromatográfiával, és ninhidriddel detektálhatók
(lila foltot ad az alfa-aminosavakkal)
- a teljes hidrolízis, elválasztás és a ninhidrines
analízis megadja az aminosavak peptidbeli számát és
relatív mennyiségét
Peptidek részleges hidrolízise
- idõnként részleges hidrolízist is alkalmaznak,
így kisebb peptideket izolálnak, melyeket könnyebb teljesen
analizálni
- a kisebb peptid darabokból néha hasznos kapcsolódási
információ határozható meg
- a kimotripszin és tripszin (emésztõ-) enzimeket
gyakran használják erre a célra, mert szelektíven
hasítják a peptideket
- a kimotripszin csak az aromás aminosavak (Phe, Tyr, Trp) karboxil
felét hasítja
- a triszin csak az erõsen bázikus aminosavak (Lys and
Arg) karboxil felét hasítja
Peptid-szekvenálás
- a peptid teljes szekvenálása sorban kb. 20 aminosavon
keresztül lehetséges
- Edman-lebontással szelektíven eltávolítható
és analizálható az N-terminális aminosav
(a szelektív reagens fenil-izotiocianát, és a lehasított
termék fenil-tiohidantoin)
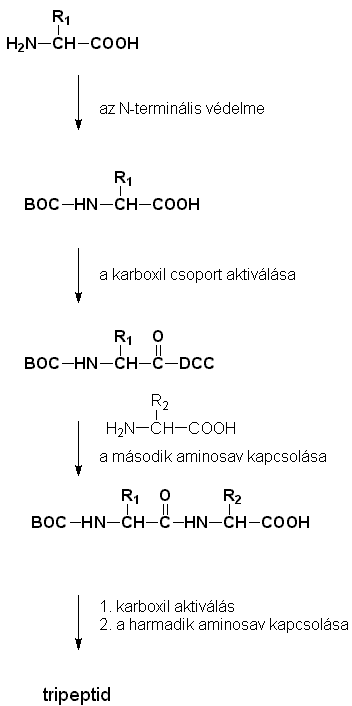
Peptidszintézis
- a teljes peptidszintézissel elõször Emil Fischer
próbálkozott
- az eljárás manapság kb. 100 aminosavig automatizálható
- a védõcsoportok nélkülözhetetlenek a
kapcsolási reakció vezetéséhez
- az AS1 N-felének védelme
(pl. BOC-amidként - késõbb könnyen eltávolítható)
- az AS1 C-felének aktiválása
(pl. DCC-vel - enyhébb, mint az SOCl2)
- az aktív AS1-et kapcsoljuk AS2 -höz
dipeptid keletkezik (AS2-AS1)
(az N-terminális még védett)
- aktiváljuk a dipeptid szabad karboxilcsoportját, majd
kapcsoljuk AS3-hoz
tripeptid keletkezik (AS1-AS2-AS3)
- megismételjük a polipeptid összes aminosavjával
- végül eltávolítjuk a védõcsoportot
az N-terminálisról
Fehérjék - természetes polipeptidek
- a fehérjék osztályozása történhet
szerkezetük, funkciójuk vagy eredetük szerint
- minden fehérje polipeptid (néha több láncból),
de kapcsolódhat más típusú molekulákhoz
is
A konjugált fehérjék más molekulákhoz
kapcsolódnak
- a glikoproteinek - cukrokkal
- a lipoproteinek - lipidekkel (apoláris zsírokkal és
olajokkal)
- a nukleoproteinek - nukleinsavakkal
- a hem fehérjék - porfirin molekulával
- a metalloproteinek - fémionokkal (gyakran a hem csoporton belül)
A fehérjék alakja
- fibrilláris fehérjék - egymás mellett alló
polipeptid láncok
általában vízben oldhatatlanok, mechanikailag erõsek
izmokban, vázanyagokban
- globuláris fehérjék - kompakt, változtatható
alak
általában vízoldhatók, a testben szállíthatók
enzimekben
A fehérjék funkciói
- enzimek - specifikus reakciók sebességszabályzó
katalizátorai
- hormonok - testi folyamatok specifikus szabályzói
- szállítás - más molekulák vagy ionok
mozgását szabályozzák
- szerkezet - izom, bõr stb.
- tárolás - tápanyag tárolás
- védelem - antitestek
A fehérjék szerkezete - elsõdleges szerkezet
- aminosav-szekvencia
- aminosav-maradékok sorrendjének meghatározása
A fehérjék másodlagos szerkezete
- a peptidlánc normál konformációja
- alfa-helix - H-kötéssel összetartott tekercs
- béta-lapok (vagy hajtogatott lapok) - H-kötésekkel
összetartott merõleges peptidláncok
A fehérjék harmadlagos szerkezete
- a fehérje teljes háromdimenziós szerkezete
- ide tartoznak a diszulfid hidak, ionos kölcsönhatások,
H-kötések, más poláros kölcsönhatások
és hidrofób kölcsönhatások
A fehérjék negyedleges szerkezete
- néhány peptidlánc nagyobb proteinegységekké
történõ aggregációja
Fehérje hômozgásának
3D modellje
Enzimek - fehérje katalizátorok
- az enzimek egyes reakciók sebességét befolyásolják
általában nagyon specifikus, mely reakciót vagy reakciócsaládot
katalizálnak
- nómenklatúra: az általuk katalizált reakció
nevéhez -áz utótag
- hidroláz - hidrolízis
- izomeráz - izomerizáció
- transzferáz - egy csoport átvitele egyik molekuláról
a másikra
- lizáz - kis molekula (mint pl. a víz) bevitele vagy eltávolítása
- oxidoreduktáz - oxidáció vagy redukció
(általában NADH-val vagy más kofaktorokkal)
- ligáz - két molekula összekapcsolása (általában
az ATP kofaktorral)
- az enzimek a reakciókat mindkét irányban képesek
katalizálni
más katalizátorokhoz hasonlóan alacsonyabb energiájú
utat nyitnak a reaktánsok és a termékek között
a reakció iránya a szubsztrátok és a kofaktorok
koncentrációjától függ
Kofaktorok
- sok enzim mûködéséhez szükséges
egy másik molekula
- sok kofaktor (koenzim) vitamin
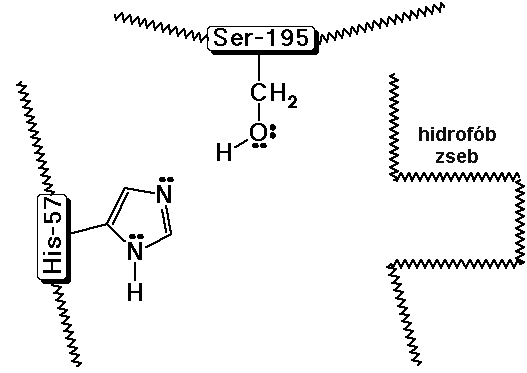
Kimotripszin - példa a proteolitikus enzimekre
- a kimotripszin hasítja az amidkötést az aromás
aminosavak mellett
- a közeli imidazolgyûrû specifikus protonátadással
vagy -felvétellel segíti a nukleofil támadást
A kimotripszin aktív helye
|
 |
Ismeretanyag
- aminosavak várható ionizáltságának
megállapítása adott pH és pKa értékük
alapján
- egyszerû peptidek elnevezése
- a peptid-szekvenálás szükséges lépéseinek
bemutatása
- a peptidszintézis szükséges lépéseinek
bemutatása
- azoknak a tulajdonságoknak az azonosítása, amelyek
a különbözõ szintû fehérjeszerkezetekkel
járnak
- polipeptid-szekvencia meghatározása részleges
hidrolízis és egyéb eredmények alapján
- kimotripszin és tripszin peptidhasító aktív
helyének felismerése
Vissza


