8. fejezet - Alkoholok
Alkoholok, éterek, fenolok
- funkciós csoportok:
- alkohol: C-O-H
- éter: C-O-C
- fenol: Ar-O-H
(Ar = arilcsoport)
Alkoholok osztályozása
- az OH-csoporthoz kapcsolódó szén alapján:
1o, 2o, 3o
- metil-alkohol
CH3OH
- etil-alkohol
CH3CH2OH (1o)
- izopropil-alkohol
(CH3)2CHOH (2o)
- t-butil-alkohol
(CH3)3COH (3o)
Alkoholok nómenklatúrája
- Az OH-csoport magas prioritású (nagyobb mint az -én
és az -in)
az alapvázban kell lennie
a számozás iránya olyan, hogy a lehetõ legkisebb
számot kapja
- -ol végzõdés a pozíció számának
megjelölésével
- a többi szubsztituenst és többszörös kötést
úgy nevezzük, mint általában
Példák alkoholokra
- triviális nevek:
alkil-alkohol

- ciklohexil-alkohol vagy ciklohexanol

- transz-4-metil-ciklohexanol
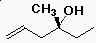
Fenol nómenklatúra
- az OH-csoport kapja az 1-es számot
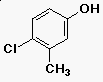
- 3-metil-4-klór-fenol
Éter nómenklatúra
- alkil-alkil-éter (triviális név)
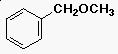
benzil-metil-éter
- alkoxi szubsztituens (IUPAC)
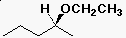
(S)-2-etoxi-pentán
Hidrogénkötés
- az sp3 O két kovalens kötéssel és
két magános elektronpárral rendelkezik
- az O magános párjai vonzzák a poláros H-kötéseket
- a kovalens O-H kötés ereje ~ 100 kcal/mól
- O...H (H-kötés) ereje ~ 5 kcal/mól
A hidrogénkötés hatása
- az alkoholok forráspontja magasabb, mint az alkánoké
(apoláros)
vagy az alkil-halogenideké (poláros, de H-kötés
nélkül)
- az éterek polárosak, de nincs H-kötés
(mind a pentán, mind a dietil-éter kb. 35 oC-on
forr)
- H-kötés tartja össze a DNS száljait ("tépõzár"
effektus)
Sav-bázis reakciók
- emlékezzünk a víz analógiájára
- reakció bázisként:
H2O + H+ <==> H3O+
ROH + H+ <==> ROH2+ (oxóniumion)
- reakció savként:
H2O + B- <==> B-H + OH-
ROH + B- <==> B-H + RO- (alkoxid-ion)
Alkoholok aciditása
- az alkoholok kb. annyira savasak, mint a víz
a MeOH savasabb, az EtOH kevésbé
a harmadrendû (3o) alkoholok sokkal gyengébb savak
- pKa értékek: 3o > 2o
> 1o > MeOH
18 , 17, 16, 15.5 (H2O: pKa = 15.7)
- tBuOH + NaOH > nem kedvezményezett
Alkoxid-anionok
- az alkohol deprotonálása alkoxid-aniont ad
CH3OH + NaNH2 > NH3 + CH3O-
Na+ (nátrium-metoxid)
- a legáltalánosabban közvetlen reakcióval
készítik, aktív fémekkel
CH3OH + Na > 1/2 H2 + CH3O-
Na+
(CH3)3COH + K > 1/2 H2
+ (CH3)3CO- K+
Fenolok aciditása
- a fenoxid-anionokat stabilizálja a rezonancia (aromás
gyûrû)
- a fenol pKa-ja 10
(a NaOH deprotonálja pH=10-en)
- az elektronvonzó csoportok tovább stabilizálják
a fenoxid-aniont
(különösen az orto- vagy a para-)
- a p-nitro-fenol pKa-ja 7
Oxigéntartalmú funkciós csoportok
- az alkoholok csak az elsõk a több lehetséges oxigéntartalmú
funkciós csoportból
- az oxidáció növeli az oxigénhez kapcsolódó
kötések számát
alkán > alkohol > karbonil > karboxil > CO2
- a redukció csökkenti az oxigénhez kapcsolódó
kötések számát
CO2 > karboxil > karbonil > alkohol > alkán
Alkoholok szintézise
- alkének hidratálása
a Markovnyikov-szabályt követi
1-hexén (H+, H2O)> 2-hexanol
- karbonil- vagy karboxil-vegyületek redukciója
redukálószerek:
nátrium-borohidrid (NaBH4)
lítium-aluminum-hidrid (LiAlH4)
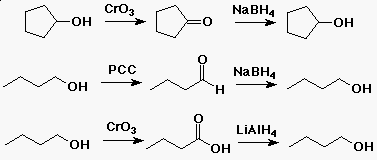
Alkoholok redox reakciói
- redukciók alkoholok elõállítására:
- aldehid vagy keton plusz NaBH4
- karbonsav vagy észter plusz LiAlH4
- alkoholok oxidációja:
- 1o alkohol aldehiddé PCC-vel (piridinium-klórkromát)
- 2o alkohol ketonná CrO3-al
- 1o alkohol karboxil savvá CrO3-al
Példa alkoholok redox reakciójára
Éterek szintézise
- Williamson éterszintézis
- SN2 reakció egy alkoxiddal (mint nukleofillel)
- az alkil-halogenidnek metilnek vagy elsõ rendûnek kell
lennie
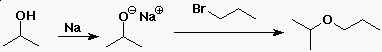
Alkoholok reakciói
- sav/bázis reakciók
- oxidációs reakciók
- elimináció (dehidratálás)
- szubsztitúció (a C-O kötés hasítása)
Szubsztitúciós reakciók
- szubsztitúció (és elimináció)
az OH rossz távozó csoport,
de protonálva jó távozó csoport keletkezik
(H2O)
- dehidratálás (E1 mechanizmus)
- halogén-szubsztitúció (SN1)
tBuOH + HBr > tBuOH2+ > tBu+ >
tBuBr
Éterek reakciója
- az éterek általában nem reaktívak
(jó oldószerek)
- erõs savakkal reagálnak
(a protonált forma alávethetõ SN1 vagy
SN2 reakciónak)
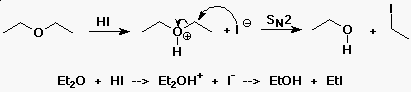
Fenolok reakciói
- a fenolos C-O kötés ritkán hasad
(SN1, SN2, E1 és E2 nem megy arilcsoporttal)
- a fenoxid-anionok jó nukleofilek
- az elektrofilek könnyen reagálnak az aromás gyûrûvel
az OH aktiváló és o,p-irányító
Kinonok
- a fenolok könnyen kinonokká oxidálódnak
- a kinonok redukciója hidrokinont ad
egy általános redox pár:
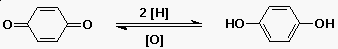
Epoxidok
- háromtagú gyûrûs éterek
- 1,2-epoxi-alkán elnevezés
- alkénekbõl állítják elõ
- a többi éterrel ellentétben, könnyen reagálnak
gyûrûfelnyílással
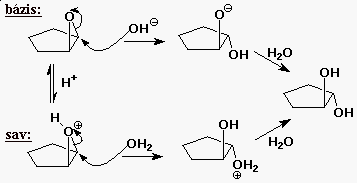
Epoxid reakciók
- savkatalizált hidratáció
- báziskatalizált hidratáció
- a termék transz diol
(ellentétes oldali támadás, mint a bromónium-ionok
reakcióinál)
Kéntartalmú funkciós csoportok
- tiolok: C-S-H csoport
(alkoholokkal analóg)
- szulfidok: C-S-C csoport
(éterekkel analóg)
- diszulfidok: C-S-S-C csoport
(peroxidokkal analóg)
- hasonlóak az oxigéntartalmú analógokhoz,
kivéve:
jobb nukleofilek
könnyebben oxidálhatók
Vissza





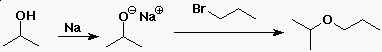
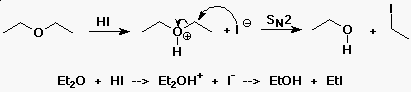
![]()
