5. fejezet - Aromás vegyületek
Aromás jelleg
- kellemes illat
- rendszerint alacsony reaktivitás
- szubsztitúció és nem addíció
- többnyire stabil
- jellegzetes gyûrûs szerkezet, delokalizált pi-kötésekkel
Benzol - stabilitás
- C6H6 (1,3,5-ciklohexatrién ?)
- nem ad C=C kettõs kötésre jellemzõ reakciókat,
nem reagál HX-xel, X2-vel, KMnO4-tal.
- szélsõséges körülmények szükségesek
a reakcióhoz
- ha lejátszódik reakció, akkor az szubsztitúció,
és nem addíció
Benzol - szerkezet
- minden szén sp2 (trigonális, 120o-os
szögek)
ideális egy sík hatszöghöz
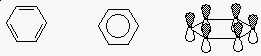
- mindegyik C-C kötés egyforma (139 pm)
- hasonlítsuk össze: a C-C kötéshossz 154 pm,
a C=C kötéshossz 134 pm
- a ciklusos konjugált pi-kötések rendszerint stabilak
(rezonancia)
Az aromás vegyületek nómenklatúrája
- monoszubsztituált benzolszármazékok
triviális nevekük van
- diszubsztituált származékok
- orto- (1,2-), meta- (1,3-), para- (1,4-)
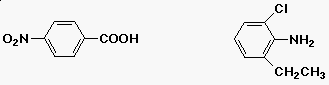 |
| p-nitro-benzoesav |
|
2-etil-6-klór-anilin |
Az aromás vegyületek nómenklatúrája
- csoportnevek
fenil- C6H5
benzil- C6H5CH2
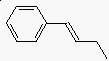
(E)-1-fenil-1-butén
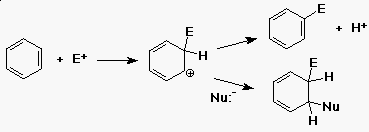
Elektrofil aromás szubsztitúció
- a benzol reakcióba vihetõ erõs elektrofilekkel
(E+)
- a köztitermék karbokation
- (mint a pi-kötésre történõ addíciónál)
- nukleofil reaktáns nem kapcsolódik a kationhoz
- (H+ távozik, a benzolgyûrû visszaalakul)
- a reakció szubsztitúció (H+-t E+-ra)
Az aromás szubsztitúció mechanizmusa
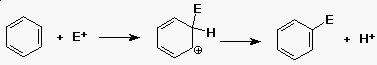
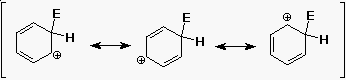
Mechanizmus - miért lassabb mint az alkének reakciója?
- A benzol elektrofil támadásának aktiválási
energiája (Ea) nagyobb, mint az alkéneké
- bár a kation intermedier delokalizált és stabilabb,
mint egy alkil-kation, a benzol stabilabb egy alkénnél
Mechanizmus - miért szubsztitúció?
- a szubsztitúció terméke visszanyeri az aromás
stabilitást
- az addíciós termék egy kevésbé stabil
konjugált dién lenne
A benzol brómozása
- az elektrofil reaktáns a Br+
- Br2 + FeBr3-ból fejlesztik
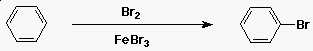
A benzol klórozása
- az elektrofil reaktáns a Cl+
- Cl2 + FeCl3-ból fejlesztik
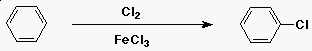
A benzol nitrálása
- az elektrofil reaktáns az NO2+
- H2SO4 + HNO3-ból fejlesztik
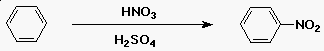
A benzol szulfonálása
- az elektrofil reaktáns a HSO3+
- H2SO4 + SO3-ból fejlesztik
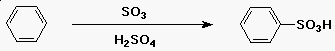
Friedel-Crafts alkilezés
- az elektrofil reaktáns egy alkil-kation (R+)
- RCl + AlCl3-ból fejlesztik
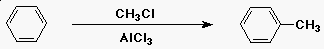
Friedel-Crafts acilezés
- az elektrofil ereaktáns egy acil-kation (RCO+)
- RCOCl + AlCl3-ból fejlesztik
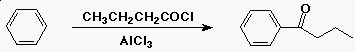
Szubsztituens-hatás
- a benzolgyûrûn lévõ szubsztituensek két
módón is befolyásolják a reakciót:
- reaktivitás - a helyettesített benzol reagálhat
lassabban és gyorsabban is, mint maga a benzol
- orientáció - az új csoport kerülhet
orto-, meta- vagy para-helyzetbe az eredeti szubsztituenshez képest
A reakcióképességre gyakorolt hatás
- aktiválás - gyorsabb reakció
- elektronküldõ csoportok esetében figyelték
meg, melyek a gyûrût elektronban gazdagabbá teszik
- dezaktiválás - lassabb reakció
- a gyûrût elektronban szegényítõ, elektronvonzó
csoportoknál figyelték meg
Irányító hatás
- a benzolgyûrûn már jelen lévõ szubsztituens
meghatározza az új csoport helyzetét
- orto-, para-irányítók: az elektronküldõ
csoportok az új csoportot fõleg orto- és para-helyzetbe
irányítják
- meta-irányítók: az elektronvonzó
csoportok az új csoportot fõleg meta-helyzetbe irányítják
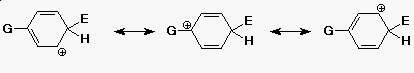
Orto-, para-irányítók
- a legstabilabb kation akkor keletkezik, ha az elektrofil orto- vagy
para-helyzetbe kapcsolódik
(stabilabb, mint a nem szubsztituált származék)
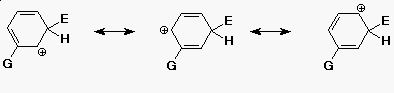
Meta irányítók
- a legstabilabb kation akkor keletkezik, ha az elektrofil meta-helyzetbe
kapcsolódik
(de ez kevésbé stabil, mint a nem szubsztituált származék)
A szubsztituensek osztályozása
- aktiváló és o,p-irányító:
alkil-, aril-, O- és N-csoportok
- dezaktiváló és m-irányító:
N+-csoportok, poláris kettõs kötések
- dezaktiváló, de o,p-irányító:
a halogének (F, Cl, Br, I)
(elektronvonzó atomok, de magános elektronpárokkal
stabilizálják a kationt, mikor az orto- vagy para-helyzetû)
Az oldallánc oxidációja
- az aromás gyûrûhöz kapcsolódó
alkilcsoport könnyen karbonsavvá oxidálódik
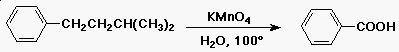
Az aromás gyûrû redukciója
- szélsõséges körülmények között
a benzolgyûrû ciklohexángyûrûvé hidrogénezhetõ

Policiklusos aromás vegyületek
- nagyobb aromás vegyületeket benzolgyûrûk összeolvadásával
kaphatunk
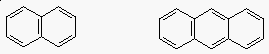 |
| naftalin |
|
antracén |
Heterociklusos aromás vegyületek
- néhány aromás vegyület szénen kívül
más atomot is tartalmaz
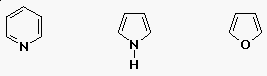 |
| piridin |
|
pirrol |
|
furán |
Szintézis-stratégia
- összetett molekulák szintézisénél
figyelemmel kell lenni a különbözõ csoportok bevitelének
sorrendjére
- retroszintetikus analízis - egyszerre egy lépéssel
gondolkodunk visszafelé (Milyen reakció adhatná ezt
a molekulát?)
Példa:
- a célvegyület: p-nitro-benzoesav
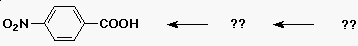
Szintézis:
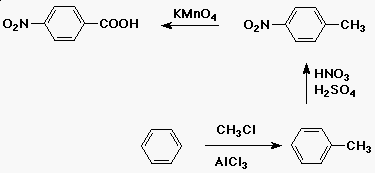
Grafit
- benzolgyûrûk kiterjedt lapjai
elektromos vezetõ
jó kenõanyag
Fullerének
- 60 szénatom gömbszerû formája benzol- és
közbensõ 5-tagú gyûrûkbõl
(futballabda alak)
Vissza
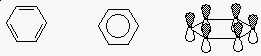
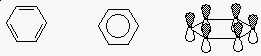
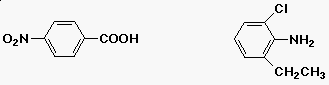




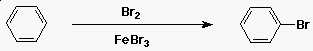
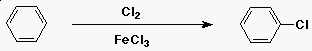
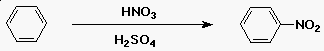
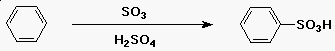
![]()
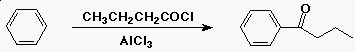


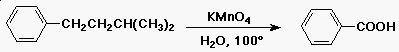
![]()


![]()
