1. fejezet - Szerkezet és kémiai kötés
Miért alakult ki a szerves kémia?
- a szénnek egyedülálló kémiája
van
- kapcsolódni tud az összes többi elemhez
- hosszú láncokban tud saját magához kapcsolódni
- a szerves kémia változatossága lenyûgözô
- sok lehetséges molekulaszerkezet
- sok lehetséges reakció
Miért tanulunk szerves kémiát?
- mit csinálnak a szerves kémikusok?
- molekulaszerkezetek, reakciók megértése
- a molekulaszerkezet és a tulajdonság viszonya
- egyéni tulajdonságú vegyületek elõállítása
- kinek van még szüksége a szerves kémiára?
- az összes életfolyamat alapja
a sok lehetséges molekulaszerkezet és reakció teszi
lehetõvé az életet
Hogyan kezeljük a változatosságot?
- nevezéktan (nomenklatúra)
- világos módszerek a molekulák és a reakciók
elnevezésére
- molekulák
- funkciós csoportok szerint csoportosítva
- reakciók
- reakciótípus szerint csoportosítva (mi történik?)
- reakciómechanizmus szerint csoportosítva (hogyan történik?)
Mit kell a szerves kémiával megoldanunk?
- összetett nevekbõl meghatározni a molekulaszerkezetet
- összetett szerkezetekben funkciós csoportokat felismerni,
jellemzõ tulajdonságokat megjósolni
- reakciómechanizmusokkal dolgozni - hogyan viselkedhet egy molekula
bizonyos körülmények között
- "úgy gondolkodni, ahogy egy molekula"
Vegyünk egy reakciót!
- CH3OH + HCl —> CH3Cl + H2O
- Reakciótípus?
- sav/bázis, oxidáció/redukció, addíció/elimináció,
szubsztitúció, átrendezõdés
- szubsztitúció -- Cl-t OH-ra (határozzuk meg a
felszakadó és keletkezõ kötéseket)
- Reakciómechanizmus ?
- hogyan zajlik a reakció (lépésrõl lépésre)
Nézzünk egy reakciómechanizmust!
- Szedjük szét a molekulát atomokra!
- Rakjuk össze a termékké!
- Mi a rossz ezzel a mechanizmussal?
- Túl sok energiát igényelne (szükségtelenül).
Egy jobb mechanizmust...
- Egyensúlyozzuk a kötés felhasítását
kötés kialakításával.
- Elõször egy sav-bázis reakció:
CH3OH + HCl —> CH3OH2+ +
Cl-
- Majd egy szubsztitúció:
CH3OH2+ + Cl- —> CH3Cl
+ H2O
A periódusos rendszer
- atomszám (meghatározza az elemet)
- atomtömeg (izotópok)
- elektron -- elektronhéjak (sorok)
- csoportok (hasonló tulajdonságok)
- betöltött elektronhéjak (nemesgázok)
- vegyérték-elektronok (kémiai kötéshez)
Lewis-szerkezetek
- az oktett szabály
- az atomok arra törekszenek, hogy 8 vegyérték-elektronjuk
legyen (betöltött héjl)
- ionos kötés
- elektronfelvétel vagy -leadás
- az elektrosztatikus vonzás stabilizálja
- kovalens kötés
- elektronmegosztás
- a legáltalánosabb kötés a szerves molekulákban
Atompályák
- hullámfügvények
- leírják az elektronok helyét
- s pályák (gömbölyû)
- p pályák (három: x,y,z)
- (súlyzó alakú - 2 lebeny)
- d pályák (4 lebeny)
- általában nem szükséges a szerves kémiához
- hibrid pályák
- kombinált pályák
Hibrid pályák
- sp hibridek (egy s plusz egy p)
- két azonos pályát ad (egyenes)
- sp2 hibridek (egy s plusz két p)
- három azonos pályát ad (háromszög alakú)
- sp3 hibridek (egy s plusz három p)
- négy azonos pályát ad (tetraéderes)
Kötés
- vonzás a negatív elektronok és a pozitív
mag között
- taszítás az elektronok között
- taszítás a magok között
- a kötés a vonzóerõk és a taszítóerõk
egyensúlya
- jellemzõ kötéstávolság és kötéserõsség
Molekulapályák
- az atompályák átfedése
- az elektronok két mag közelében vannak
- kötõ és nem kötõ kombinációk
Szigma-kötések
- hengerszimmetria
- az atompályák végeinek átfedésével
keletkezik
Pi-kötések
- a kötéstengelyen keresztül csomósík
- az atompályák oldalának átfedésével
keletkezik
Szerves molekulák ábrázolása
- Lewis-képlet
- minden elektront ábrázolunk
- Kekulé-képlet
- a kötéseket vonalak jelölik
- a magános elektronpárokat néha elhagyjuk
- vonalas képlet
- elhagyjuk a magános elektronpárokat
- elhagyjuk a hidrogént a szénatomokon
- elhagyjuk a szénatomokat
(feltételezzük, hogy minden kötés végén
szén van)
3 dimenziós szerkezetek
- pontozott vonal / ék
- golyó és pálcika
- térkitöltés
A kémiai szerkezet megjelenítése
- Név (triviális vagy szisztematikus)
- Tömör képlet (ahogy általában nyomtatva
van)
- Lewis-képlet (az összes atom és kötés
fel van tüntetve)
- Vonalas képlet (elhagyja a hidrogéneket; a szénatomokat
a csúcsok jelentik)
- 3-D szerkezet (jelzi a kötések térbeli elhelyezkedését)
- Golyó és pálcika képlet (mit egy molekulamodell)
- Térkitöltéses modell (az elektroneloszlás
teljes méretét közelíti)
metán: CH4 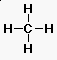
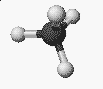

benzol: C6H6 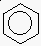
penicillin: 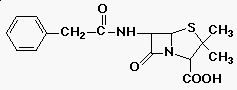
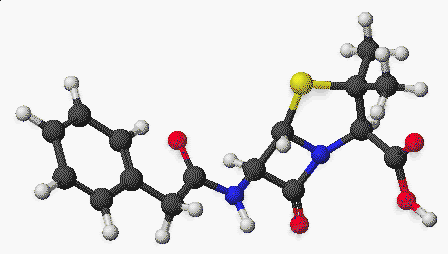
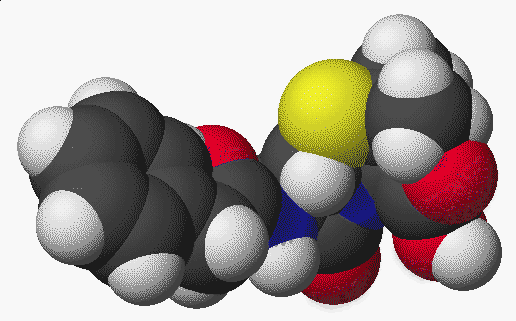
Próbáljunk ki egy 3-D-s képet:
1) Kattints a "Próbáld ki!"-ra ha elolvastad az
instrukciókat.
2) Keresztezd a szemeid (bandzsíts) úgy, hogy két
dupla képet láss.
3) Nézz úgy, hogy a középsõ képek
átfedjék egymást.
Próbáld ki!
Jellemzõ vegyérték
- H: 1 vegyérték-elektron, 1 kötés
- C: 4 vegyérték-elektron, 4 kötés
- N: 5 vegyérték-elektron, 3 kötés + 1 magános
elektronpár
- O: 6 vegyérték-elektron, 2 kötés + 2 magános
elektronpár
- F: 7 vegyérték-elektron, 1 kötés + 3 magános
elektronpár
Molekulapályák
- H + H —> H-H
- s + s —> szigma-kötés
- H-H kötéshossz: 0,74 A
- H-H kötéserõsség: 104 kcal/mol
Metán
- C + 4 H —> CH4
- sp3 + s —> négy szigma-kötés
- C-H kötéshossz: 1,10 A
- C-H kötéserõsség: 104 kcal/mol
- elhelyezkedés - tetraéderes
- kötésszögek: 109,5o
Miért hibrid pályák?
- jó alak (irány)
- a kötésnél nagyfokú átfedés
lehetséges
- maximális az elektronok sûrûsége az atomok
között
- jó irányítottság
- minimális taszítás a pályák között
Etán
- CH3CH3
- egy C-C szigma-kötést tartalmaz
- sp3 - sp3 pályák átfedése
- C-C kötéshossz: 1,54 A
- C-C kötéserõsség: 88 kcal/mol
- C-H kötéshossz: 1,10 A
- C-H kötéserõsség: 98 kcal/mol
- irányítottság - két tetraéder
Etilén
- CH2=CH2
- egy C=C kettõs kötést tartalmaz (alkén család)
- sp2 - sp2 pályák átfedése
(szigma-kötés)
- p - p pályák átfedése (pi-kötés)
- C-C kötéshossz : 1,33 A
- C-C kötéserõsség: 152 kcal/mol
- C-H kötéshossz: 1,08 A
- C-H kötéserõsség: 103 kcal/mol
- irányítottság - sík
- kötésszög 120o
Acetilén
- HC=CH
- egy C=C hármas kötést tartalmaz
(alkin család)
- sp - sp pályák átfedése (szigma-kötés)
- p - p pályák átfedése (két pi-kötés)
- C-C kötéshossz: 1,20 A
- C-C kötéserõsség: 200 kcal/mol
- C-H kötéshossz: 1,06 A
- C-H kötéserõsség: 125 kcal/mol
- irányítottság - egyenes
Kötéstendenciák
A kötéshosszak Angströmben (a kötéserõsségek
kcal/mol-ban)
| Vegyület |
Hibridizáció |
C-C kötés |
C-H kötés |
| Etán |
sp3 |
1.54 (88) |
1.10 (98) |
| Etilén |
sp2 |
1.33 (152) |
1.08 (103) |
| Acetilén |
sp |
1.20 (200) |
1.06 (125) |
- a többszörös kötések erõsebbek
- a rövidebb kötések erõsebbek
Elektronegativitás
- egy atom elektronvonzó hajlama
- a periódusos rendszerben az elektronegativitás jobbra
és felfelé növekszik
- F > O > Cl ~ N > Br > C > H > fémek
Poláris kovalens kötés
- a kovalens kötésben résztvevõ elektronok
nem mindig egyformán megosztottak
a H-Cl ténylegesen d+ H-Cl d-
ahol a d+ és a d- a parciális töltést
jelöli
A szén kötéseinek polárossága
- a C-C kötés nem poláros
- a C-H kötés általában apolárosnak
tekinthetõ
- a C-X kötés polarizált (d+)
X = F, Cl, Br, I, O, S, N
- a C-M kötés polarizált (d-)
M = fém
Bronsted-Lowry sav-bázis elmélet
- sav - H+ donor
- bázis - H+ akceptor
NH3 + H2O <==> NH4+ +
OH-
bázis + sav <==> sav + bázis
- figyeljük meg a konjugált sav-bázis párt
(H+-nal különböznek)
A sav disszociációs állandója (Ka)
általában leegyszerûsítve
HA <==> H+ + A-
Saverõsség (pKa)
- erõsebb savaknak nagyobb a Ka-értékük
HCl esetén Ka = 107
CH3COOH (ecetsav) esetén Ka = 10-5
- pKa = - log Ka
- erõsebb savaknak kisebb a pKa -értékük
HCl: pKa = -7
CH3COOH: pKa = 5
pH és pKa
- Ka = [H+][A-]/[HA]
- pKa = pH - log([A-]/[HA])
- pH = pKa, [A- ] = [HA]
- pH < pKa, HA van túlsúlyban
- pH > pKa, A- van túlsúlyban
például az ecetsav esetében pH = 7 mellett
[CH3COO-] > [CH3COOH]
Sav-bázis reakciók
| CH3COOH + OH- <==> CH3COO-
+ H2O |
| sav |
bázis |
bázis |
sav |
pKa = 5; pKa = 15.7
erõsebb sav
a reakció a jobb oldal felé tolódik el
| CH3COOH + H2O <==> CH3COO-
+ H3O+ |
| sav |
bázis |
bázis |
sav |
pKa = 5; pKa = 1.7
a reakció a bal oldal felé tolódik el
| HC=CH + Na+NH2-
<==> HC=C-Na+ + NH3 |
| sav |
bázis |
bázis |
sav |
pKa = 25; pKa = 35
a reakció a jobb oldal felé tolódik el
| CH3OH + CN- <==> CH3O-
+ HCN |
| sav |
bázis |
bázis |
sav |
pKa = 16; pKa = 9
a reakció a bal oldal felé tolódik el
Lewis-savak
- sav - felvesz egy elektronpárt
- bázis - lead egy elektronpárt
- (kialakul egy új kovalens kötés)
H+ + H2O <==> H3O+
L-sav L-bázis új O-H kötés
BF3 + NH3 <==> F3B-NH3
L-sav L-bázis új B-N kötés
Formális töltés
- vegyérték-elektronok száma - (kötések
száma + magános elektronok száma)
- (Hány e- van "szabály szerint" ebben
az atomban?)
- (Hány e- van ebben a vegyületben?)
Rezonancia
- egynél több lehetséges Lewis-struktúra egy
vegyülethez
- Melyik a legjobb Lewis-struktúra?
- Kövesd az oktett szabályt!
- Az elektronegativitás határozza meg a töltés
helyét
szén-monoxid
nitro-metán
Vissza






![]()





