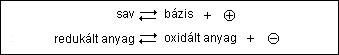Johannes Nicolaus Brønsted
(1879–1947)
Néhány megjegyzés a savak és
a bázisok elméletéhez
Recueil des Travaux Chimiques des Pays-Bas, 42, 718–728
(1923)
Részletek a 718–721. és a 728. oldalról
(A ChemTeam
gyûjteményében megjelent részletek alapján)
 Kísérlet
a savak és a bázisok definíciójára.
Mióta Arrhenius megalkotta az elektrolitos
disszociáció elméletét, nem bírálták
szigorúan azt a definíciót – legalábbis ami
a savakat illeti –, hogy a savak és a bázisok olyan anyagok,
amelyek oldatban hidrogén- vagy hidroxilionokra bomlanak. Kitartóan
ragaszkodunk ahhoz az elképzeléshez, hogy az A vegyület
sav, ha a következõ séma szerint bomlik el részben
vagy egészen, ha feloldjuk:
Kísérlet
a savak és a bázisok definíciójára.
Mióta Arrhenius megalkotta az elektrolitos
disszociáció elméletét, nem bírálták
szigorúan azt a definíciót – legalábbis ami
a savakat illeti –, hogy a savak és a bázisok olyan anyagok,
amelyek oldatban hidrogén- vagy hidroxilionokra bomlanak. Kitartóan
ragaszkodunk ahhoz az elképzeléshez, hogy az A vegyület
sav, ha a következõ séma szerint bomlik el részben
vagy egészen, ha feloldjuk:
A bázisokról alkotott felfogásunkat azonban többféle
módon is megpróbálták módosítani.
Elsõsorban P. Pfeiffer – számos fém akva- és
hidroxokomplexével végzett fontos vizsgálatai alapján
– adott annak hangot, hogy a bázisok savak jelenlétében
sókat képeznek, ami az elektrolitos disszociáció
elméletének szóhasználatával élve
ahhoz a definícióhoz vezet, hogy a bázisok olyan anyagok,
amelyek hidrogénionokat vehetnek fel. Bár ezt a gondolatmenetet
meggyõzõen végigvihetjük a jelen dolgozatban,
fontos elemei ellenére sem szolgálhat alapként a bázis
definíciójának megváltoztatásához.
Michaelis Hydrogen Ion Concentration címû könyvében
általánosabban kezelte a problémát. Õ
a következõt tekinti a bázis egy lehetséges definíciójának:
a bázis olyan speciális, elektromos semleges molekulafajta,
amely hidrogénion megkötésére képes, és
ezáltal pozitív ionná válhat. Michaelis további
fejtegetései azonban a bázis szokásos definícióján
alapulnak, és a szerzõ még nemvizes közegek esetén
is a bázisok alapvetõ alkotórészének
tekinti a hidroxiliont.
A jelen rövid dolgozat célja, hogy rámutasson a bázis
egy módosított definíciójából
eredõ elõnyökre.
Azonnal világossá válik, hogy milyen elõnyökkel
jár, ha a bázist hidrogénion megkötésére
képes anyagként definiáljuk. Az (1) séma, amely
a sav (A) fogalmát definiálja, egyszersmind a bázis
(B) fogalmát is definiálja, s így a savas és
a bázikus tulajdonságok kölcsönös kapcsolatát
is a legvilágosabb és legegyszerûbb módon mutatja.
A savak és bázisok kölcsönös definíciójának
alapjául szolgáló (1) séma elõnyei nem
csupán formálisak. Például az ammónia
bázikus tulajdonságait kifejezhetjük a következõ
egyenlettel:
és a szokásos formában is megadhatjuk:
| NH4+ + OH¯ <===> NH4OH |
(3) |
Mindkét séma, amint jól ismert, vizes oldatban
egymással egyenértékû, tehát a (2) és
(3) egyenlet felhasználásával azonos egyensúlyi
feltételeket vezethetünk le termodinamikai szempontból,
a hígításkor mutatkozó bázikus és
savas tulajdonságokból, a részleges semlegesítésbõl
stb. Az NH4OH vegyület, a hidratált ammónia
jelenléte, ennélfogva a (3) egyenlet szerinti hidroxilion-képzõdés
természetesen vizes oldatokra korlátozódik.
Ezzel eljutottunk a bázis (2) és (3) egyenlet szerinti
értelmezésének alapvetõ különbségéhez.
Ha a (3) sémát fogadjuk el a bázisok jellemzésére
szolgáló alkalmas kifejezésként, minden egyes
oldószer esetén külön kellene definiálnunk
a bázist. Elméletileg azonban a savas és bázikus
tulajdonságok függetlenek az oldószer jellegétõl,
s a savak és bázisok fogalma valóban olyan általános,
hogy ezeket a fogalmakat szükségképpen az önkényes
oldószerek jellegétõl függetlenül kell formába
öntenünk. Ezért a (3) sémától eltekintünk.
A (2) séma tükrözi az ammónia bázikusságát,
és az általános (1) séma szolgál a bázis
abszolút definíciójára.
A fenti meggondolások eredménye precízebben a következõképpen
fogalmazható meg: a savak, illetve a bázisok olyan anyagok,
amelyek hidrogénionok leadására, illetve felvételére
képesek. A savak és bázisok definíciójának
lényegét ismét az (1) kifejezés szemlélteti:
| A |
<===> |
B |
+ H+ |
(1) |
| (sav) |
|
(bázis) |
amely semmi többet nem árul el A és B tulajdonságairól.
Azokat a savakat és bázisokat, amelyek az (1) szerinti kapcsolatban
állnak egymással, egymásnak megfelelõ savaknak
és bázisoknak nevezzük.
A kifejezés alakjából az következik, hogy
az egymásnak megfelelõ savak és bázisok elektromos
töltésállapota eltérõ. Ha A elektromosan
semleges, mint a közönséges savmolekulák, B negatív
töltésú, például:
| CH3COOH |
<===> |
CH3COO¯ |
+ H+ |
| (sav) |
|
(bázis) |
ahol az acetátion bázisként viselkedik. Ha A pozitív
töltésû, B-nek semlegesnek kell lennie, mint például
az ammóniumion disszociációjakor:
| NH4+ |
<===> |
NH3 |
+ H+ |
| (sav) |
|
(bázis) |
Negatív töltésû sav például az
oxalátion, amely a következõképpen disszociál:
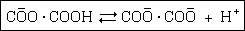
stb.
A savak és a bázisok általános definíciójából
az is következik, hogy az ionokat is savakként és bázisokként
kell kezelni. A sav- és a bázismolekula elektromos állapota
– elméleti szempontból – nem játszik szerepet ebben
a felfogásban. Gyakorlati szempontból hasznos lenne, ha a
kölönbözõ egyensúlyokat a töltés
szerint osztályozhatnánk, ezért a következõ
terminológiát vezettem be erre a célra (I. táblázat):
| I. táblázat |
Elektromos
töltés |
A sav vagy
a bázis neve |
Példák |
| Pozitív |
kation-sav |
NH4+ |
| Pozitív |
kation-bázis |
NH2 . C6H4 .
C6H4 . NH3+ |
| Semleges |
semleges sav |
CH3COOH |
| Semleges |
semlges bázis |
NH3 |
| Negatív |
anion-sav |
 |
| Negatív |
anion-bázis |
CH3COO¯ |
Az (1) séma – a sav-bázis rendszer sajátos
elektromos jellegétõl függetlenül – azt mutatja,
hogy a szimmetria, amelyet a sav és a bázis viselkedése
szempontjából alapvetõnek tartottunk a szokásos
reprezentációban, eltûnik az új reprezentációban.
A savak és a bázisok kölcsönös viselkedésének
adott példáján keresztül azonban közvetlenül
kifejezésre jut.
A hidrogénion, illetve az egymásnak megfelelõ sav
és bázis közötti egyensúly, amelyet az (1)
séma ír le, egyszerû sav-bázis egyensúlynak
nevezhetõ. Két egyszerû rendszer összekeverésekor
kettõs sav-bázis rendszer keletkezik és a kialakuló
sav-bázis egyensúly mindig a következõképpen
önthetõ formába:
| sav1 + bázis2 <===> sav2
+ bázis1 |
(4) |
Ez az egyensúly számos fontos reakció esetében
fennáll; ilyen például a semlegesítés,
a hidrolízis, az indikátorreakció stb.
[A szerzõ ezután számos esetre alkalmazza elméletét.]
Összegzés. A savak és bázisok kémiai
jellege a legegyszerûbben és a legáltalánosabban
a következõ sémával definiálható:
sav <===> bázis + H+
A hidroxilion nem játszik kitüntetett szerepet a bázikus
tulajdonságok megjelenésében.
A savak és a bázisok erõsségének
összehasonlítására nincs logikus mértékünk.
A neutralitás szokásos felfogása nem létezik,
vagy csak önkényes definíció esetén létezik.
Ezért az oldószer, például a víz, elméleti
szempontból nem tekinthetõ semlegesnek.
A sav-bázis és redukciós-oxidációs
egyensúly analóg:
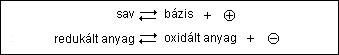
Az elsõ esetben a pozitív, a másodikban a negatív
elektron játszik szerepet.
| Vissza |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |
 Kísérlet
a savak és a bázisok definíciójára.
Mióta Arrhenius megalkotta az elektrolitos
disszociáció elméletét, nem bírálták
szigorúan azt a definíciót – legalábbis ami
a savakat illeti –, hogy a savak és a bázisok olyan anyagok,
amelyek oldatban hidrogén- vagy hidroxilionokra bomlanak. Kitartóan
ragaszkodunk ahhoz az elképzeléshez, hogy az A vegyület
sav, ha a következõ séma szerint bomlik el részben
vagy egészen, ha feloldjuk:
Kísérlet
a savak és a bázisok definíciójára.
Mióta Arrhenius megalkotta az elektrolitos
disszociáció elméletét, nem bírálták
szigorúan azt a definíciót – legalábbis ami
a savakat illeti –, hogy a savak és a bázisok olyan anyagok,
amelyek oldatban hidrogén- vagy hidroxilionokra bomlanak. Kitartóan
ragaszkodunk ahhoz az elképzeléshez, hogy az A vegyület
sav, ha a következõ séma szerint bomlik el részben
vagy egészen, ha feloldjuk: