 |
 |
| formaldehid | metilalkohol |
Természet Világa, 1974. december
Kajtár Márton
"Kémia a térben"
Van't Hoff emlékezetére
Ez az esztendõ centenárium a kémiában. A sztereokémia századik születésnapját ünnepeljük. Száz esztendôvel ezelôtt két fiatal, akkor még teljesen "névtelen" kémikus, Jacobus Henricus van 't Hoff és Joseph Achille Le Bel az egyik holland, a másik francia majdnem egyszerre, de egymástól függetlenül vállalkozott arra, hogy kifejtse nézeteit a kémia akkor megoldhatatlannak látszó nagy titkáról, az anyag parányi alkatrészeinek, a molekuláknak térbeli szerkezetérôl. Az évforduló alkalmat kínál, hogy elgondolkozzunk a kémia egész sajátos gondolatvilágának és szemléletmódjának kialakulásáról, amely az "isteni szikra" kipattanásához vezetett, és legalább fôbb vonásaiban megkíséreljük felmérni, milyen mélyen hatott az új felismerés nyomán kibontakozó sztereokémia az anyag szervezettségérôl alkotott mai képünk kialakulására.
Kísérjük végig annak a logikus és következetes,
de meglehetôsen elvont szemléletnek a kialakulását,
amely a kémián belül az anyagról kialakult. Minden
tudománynak az a célja, hogy az anyagi világ elkápráztató
sokféleségében valahogy rendet teremtsen. A közös
vonások, a rendezô elvek kiemelése, az absztrakció
iránya azonban minden tudományban más és más,
s ennek megfelelôen a megteremtett rend is sokféle lehet.
Minél közelebbrôl ragadja meg a kiemelt rendezô
elvek tartalma az anyag valóságos struktúrájában
rejlô jellegzetességeket, annál nagyobb a rendalkotó
elv teljesítôképessége,
annál szélesebbek kiterjesztésének határai.
A kémia az anyagok sokféleségének azt a közös
vonását ragadta meg, hogy azok néhány egyszerû
elemi alkatrészre bonthatók fel. A kvalitatív összetétel
érdekes szempont, mert a minôségi változatosságot
minôségi rendezô elv bevezetésével redukálja
néhány egyszerû elem jelenlétének kérdésére.
Be kell vallanunk azonban, hogy ez az elv csak meglehetôsen szûk
körben adott magyarázatot az anyagi világ sajátosságainak
sokféleségére. A minôségi összetétel
azonossága alapján egymástól látszólag
nagyon is eltérô sajátságú anyagok kerülnek
egy csoportba, a látszólag hasonlók meg különbözôbe.
A "külsô szemlélô" számára
sokszor nagyon meglepô a kémiának ez a kategorizálása.
A metángáz és a neongáz sok tekintetben nagyon
hasonlít egymáshoz: mindegyik nehezen cseppfolyósítható,
színtelen, szagtalan gáz, sok fizikai állandójuk
is meglehetôsen közel áll egymáshoz. A vegyész
szemében a két gáz mégis alapvetôen különbözik,
mert a neon elem, amely csak neonatomokból áll, a metán
viszont szénbôl és hidrogénbôl összetett
vegyület: molekulái szén- és hidrogénatomokból
épülnek fel. A metángáz rokona ezért nem
a neon, hanem pl. a benzin vagy a hófehér paraffin, amelybôl
a gyertya készül. Az utóbbiak ugyanis, bármennyire
különböznek is külsôleg a metángáztól,
megfelelô módszerrel szénre és hidrogénre
bonthatók, ami a vegyész számára azt jelenti,
hogy molekuláik szén- és hidrogénatomokból
épülnek fel. Mindhárom anyag a szénhidrogének
nagy csoportjába tartozik. Ne felejtsük el, hogy valami közös
mégiscsak van a külsôleg annyira eltérônek
látszó három anyagban: mindegyiket arra használjuk,
hogy elégetjük: egyiket így, a másikat úgy,
de ez már a vegyész számára megnyugtatóvá
teszi az összetétel közös vonásainak hangsúlyozását.
Az azonos elemekbôl felépített anyagok között
is különbséget tehetünk, ha az elemi alkatrészek
mennyiségi arányát is figyelembe vesszük. Ez
a vegyész számára már azt is megmondja, hogy
a különbözô atomokból hány-hány
darab vesz részt a kérdéses anyag molekuláinak
felépítésében. Így már különbséget
lehet tenni a metán, a benzin meg a paraffin között. A
metánmolekulákat egyetlen szénatom és négy
hidrogénatom együttese alkotja, a benzinét kereken
nyolc szén- és tizennyolc hidrogénatom, a paraffin
molekuláiban meg legalább húsz szénatom és
negyvenkét hidrogénatom kapcsolódik egymáshoz.
Ezt fejezi ki az egyes anyagok ún. összegképlete:
| CH4 metán |
C8H18 benzin |
C20H42 paraffin |
Rendszerint legalábbis a szerves vegyületek jellemzésében ez sem ér azonban sokkal többet. A selyemszálnak így sem a vattaszál lesz a rokona, hanem a sajt, a vattának meg a fadarab vagy a keményítôpor, távolabbról meg a kockacukor. Hosszan sorolhatnánk a vegyész "rendteremtô" elveinek furcsa következményeit, de a kémia érveivel minden esetben bebizonyíthatnánk, van ráció, sôt mély valóságtartalom abban, hogy a különbözô anyagok sajátságait valamiképpen molekuláik felépítésével és szerkezetével hozzuk kapcsolatba.
A múlt század elsô felében kialakult az atomok vegyértékének fogalma. Sok egyszerû összetéteIû anyagban meghatározták az alkotóelemek súlyarányát, s a sok számadat összevetésével megállapították, hogy mindegyik atomra jellemzô, hány másik atommal tud molekulává kapcsolódni. A vízmolelekulában egy oxigénatom két hidrogénatommal társul, a metánban a szénatom négy hidrogénnel; nem csoda, hogy a szén-dioxidban a szén két oxigénatomot tud megkötni. Hasonló összehasonlítások alapján arra a következtetésre jutottak, hogy a hidrogénatom egy vegyértékû, az oxigénatom kettô, a nitrogén három, a szénatom meg négy vegyértékû. Ennek alapján sok egyszerû vegyület molekulájáról már azt is el lehetett dönteni, hogy benne az egyes atomok milyen másikkal kapcsolódhatnak közvetlenül, hogy mindegyiknek minden vegyértéke kötésben legyen. A formaldehid-molekulában egy szén-, egy oxigén- meg két hidrogénatom van összesen. A vegyértékek alapján könnyen megállapítható, hogy a szénatom két vegyértékkel az oxigénhez, eggyel-eggyel meg a két hidrogénatomhoz kapcsolódik. A metilalkohol molekuláiban kettôvel több a hidrogénatom. Ha mind a négyet megkötné a szénatom, az oxigén már nem tudna mihez kapcsolódni (a hidrogénatomok ugyanis csak egyetlen másik atomhoz kapcsolódhatnak, csak egy vegyértékük van). Csak úgy képzelhetô el a molekula, hagy a szénatom három hidrogénatom mellett egy vegyértékével az oxigént köti, s ez köti meg a maradék vegyértékével a negyedik hidrogénatomot.
 |
 |
| formaldehid | metilalkohol |
Ezzel tehát a molekulát felépítô különbözô atomoknak már nemcsak a számát ismerjük, hanem az atomok kapcsolódási sorrendjét is; ezt nevezzük a molekula konstitúciójának. A konstitúció sokkal részletesebb jellemzôje az egyes anyagoknak, mint az összegképlettel kifejezett kvantitatív elemi összetétel. Sok olyan anyagot ismerünk ugyanis, melyeknek azonos az összegképlete (vagyis molekuláik ugyanolyan atomokból épülnek fel), sajátságaik mégis nagyon eltérnek egymástól; ezeket izomer vegyületeknek nevezzük. Ilyen pl. a jól ismert etilalkohol és egy robbanékony gáz, a dimetiléter. Az összegképlete mindegyiknek C2H6O. Valójában az izoméria jelenségének felfedezése irányította a figyelmet a molekulák konstitúciójának kérdésére. Ha az anyagok sajátságait a molekulák szerkezete szabja meg, akkor a különbözô sajátságú anyagok molekuláinak is különbözniük kell. Mivel elôfordul olyan eset, hogy különbözô sajátságú anyagok molekulái ugyanazokból az atomokból épülnek fel, az atomok száma még nem jellemzi a molekulát, ismernünk kell azt is, hogy azok hogyan kapcsolódnak egymáshoz a molekulában. A vegyértékek alapján két szénatom, hat hidrogénatom és egy oxigénatom kétféleképpen is összekapcsolódhat úgy egymással, hogy minden atom vegyértékei le legyenek kötve:
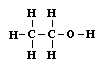 I |
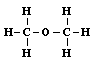 II |
Mivel éppen két olyan anyagot ismerünk, amelynek egyformán C2H6O az összegképlete, logikusan következik, hogy a két konstitúció közül egyik az etilalkohol, másik a dimetiléter molekuláját ábrázolja. Most már az a kérdés, melyik melyiket. Az etilalkohol kémiai sajátságaiban sokkal jobban hasonlít a metilalkoholhoz, mint a dimetiléter. Mivel az I konstitúciójú molekulában az oxigénatom egyik vegyértékével szénatomhoz, a másikkal meg hidrogénatomhoz kapcsolódik, akárcsak a metilalkohol molekulájában, feltételezhetô, hogy az I képlet az etilalkohol molekuláját felépítô atomok kapcsolódásmódját szimbolizálja, a II képlet pedig a dimetiléterét.
Lehet, hogy túlságosan egyszerûnek és primitívnek tûnik ez az okoskodás, pedig a gondolatmenet híven követi a kémiai molekulafogalom kialakulásának alapjául szolgáló kísérleti tények és elméleti megfontolások kapcsolatát. Ma már sok közvetlen bizonyítékunk van a molekulák létérôl, vannak módszerek, melyekkel ha mégoly bonyolult fizikai jelenségek sorozatán keresztül is a molekulát szinte lefényképezhetjük. Ennek megfelelôen a molekulákról kialakult mai képünk meglehetôsen részlétes, közvetlen, szinte kézzelfogható. A tudományos kémia kialakulásának korszakában azonban a feltételezett, de közvetlenül soha meg nem figyelhetô molekulák vizsgálatának csak egyetlen lehetséges "módszere" volt: az izoméria, vagyis a "különbözô sajátság, különbözô molekula" elvének következetes érvényesítése. Így jutottak el mint láttuk a konstítúció fogalmához is. A szerkezeti képletben rejtjelesen ha úgy tetszik, csak szimbolikusan ábrázolt konstitúció már nagyon sok információt tartalmaz az anyagok sajátságairól. Az anyag szerkezetének iyen szintû ismerete már azt is lehetôvé tette, hogy a vegyész céltudatos tevékenységgel elôre meghatározott sajátságú, azelôtt sohasem volt, új anyagokat teremtsen. A múlt század szintetikus kémiájának sok sikere mind azt bizonyítja, hogy a molekulák szerkezetérôl a konstitúcióban összefoglalt kép az anyag valódi szerkezetének valamilyen lényeges vonását ragadja meg.
A konstitúciót leíró képlet azonban csak rejtjeles szimbólum, a sajátságokra vonatkozó sok kísérleti tapasztalat tömör összefoglalása, de a molekulák térbeli szerkezetérôl e képletek nem mondanak semmit. Maga Kekulé, a szerkezeti kémia megalapítója sem látott bennük a molekulák valóságos szerkezetére utaló realitást. Pedig Wollaston már 1808-ban arról írt egyik értekezésében, hogy a Dalton-féle atomokból felépülô molekulák térbeli képzôdmények, s hogy kölcsönhatásaik megértéséhez háromdimenziós, térbeli geometriájukat is ismernünk kellene. A molekulák térbeli szerkezete a kor legtöbb kémikusa szemében a kémia legnagyobb, tán soha meg nem oldható rejtélyének látszott. Ez alapjában véve érthetô, hiszen molekulát soha senki közvetlenül nem látott, nem tapasztalt. A fantázia, természetesen, szabadon szárnyalhat, a molekulák szerkezetét mindenki úgy képzelheti el, ahogy akarja. Csakhogy annak nem sok köze lehet a valósághoz...
A tudomány története mégis arról tanúskodik, hogy egy ennyire elvont kérdést, mint a láthatatlan, közvetlenül nem vizsgálható (talán nem is létezô?) molekulák térbeli szerkezetét is meg lehetett közelíteni a kémia akkori sajátos módszereivel és következetes, de mértéktartó gondolkodással. Nem tudjuk eléggé hangsúlyozni, hogy a kémia mûvelése különösen a tudomány kialakulásának idején milyen nagy képzelôerôt s ugyanakkor milyen elvont és következetes gondolkodást kívánt. Hiszen soha nem a valóságos kísérleti anyag a szép csillogó kristály vagy az illatos folyadék közvetlenül látható, érzékelhetô, kézzel fogható sajátságai alapján kellett a következtetéseket levonni, hanem valami elvont fogalom, a soha közvetlenül nem tapasztalt molekula, ill. annak valami rejtjeles képlettel szimbolizált szerkezete alapján. Ahogy a molekulákban kötött atomok kapcsolódásmódjának, a konstitúciónak a gondolatához az izoméria vezetett, ugyanúgy a térszerkezet kérdését is az izomérián keresztül lehetett megközelíteni. Felfedeztek néhány olyan izomériaesetet, melyek a konstitúció elve alapján megmagyarázhatatlanok voltak. Az aludttejbôl és a húsból (izomból) elkülönítettek két vegyületet, amelynek nemcsak az elemi összetétele, vagyis az összegképlete (C3H6O3), hanem a kémiai sajátságok és átalakulások alapján megállapított konstitúciója is azonos volt:
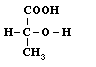
Az aludttejbôl nyert tejsav és a "hús-tejsav" azonban bár minden fizikai és kémiai sajátságuk a várakozásnak megfelelôen azonos volt egyetlen különleges sajátságban mégis eltért egymástól: az oldatukon átbocsátott síkban polarizált fény polarizációs síkját az egyik jobbra, a másik meg balra forgatta el. Bármilyen lényegtelennek látszik is ez a különbség kémiai szempontból, a kémiától bármennyire idegen sajátságra vonatkozzék is, a következetes, tudományos gondolkodás nem hagyhatta figyelmen kívül. Ha két vegyület bármilyen sajátságban különbözik egymástól, valamilyen különbségnek molekuláik szerkezetében is lennie kell. Mivel pedig konstitúciójuk azonosnak bizonyult, be kellett látni, hogy a konstitúció ismerete még nem elegendô ahhoz, hogy az anyagok minden különbségét, vagyis a molekulák szerkezeti variációinak minden lehetôségét tükrözze. A különbséget a molekulák térbeli felépítésében kell keresni. A molekulák térbeli felépítésérõl a képzelet nagyon sokféle képet alakíthat ki, a tudománynak azonban a tapasztalt izomériajelenség megmagyarázásához csak két lehetôségre volt szüksége.
A probléma megoldását majdnem egyszerre, de egymástól függetlenül két fiatal kémikus, a holland J. H. van't Hoff és a francia J. A. Le Bel találta meg. A 23 éves van't Hoff, aki nem sokkal korábban fejezte be egyetemi tanulmányait az utrechti egyetemen, s utána néhány hónapot töltött Bonnban Kekulé, majd Párizs ban Wurtz mellett, mielôtt megkezdte volna doktori munkáját, a nyári vakáció alatt írt egy mindössze 12 oldalas kis tanulmányt. Az 1874. szeptember 5-én keltezett rövid dolgozatnak, amely nem valami tudományos folyóiratban jelent meg, hanem egy füzetke alakjában (van't Hoff maga adta ki), jó hosszú volt a címe. Magyarul így hangzik: "Javaslat a kémiában jelenleg használt szerkezeti képleteknek a térbe való kiterjesztésére, továbbá egy ezzel kapcsolatos megjegyzés a szerves vegyületek optikai forgatóképessége és kémiai konstitúciója közötti összefüggésrôl". Az alapgondolat a következô. Mivel a molekulák háromdimenziós, térbeli képzôdmények, feltehetô, hogy az atomok vegyértékei a térben irányítottak, vagyis az egy atomhoz kapcsolódó atomok viszonylagos térbeli elhelyezkedése meghatározott. A konstitúció alapján nem értelmezhetô izomériajelenségek legalábbis az akkor ismert néhány példa mindig olyan szénvegyületek esetében lépnek fel, melyek molekuláiban van legalább egy olyan szénatom, amely minden vegyértékével más atomhoz, ill. atomcsoporthoz kapcsolódik. Ráadásul az ilyen vegyületek mindig optikailag aktívaknak bizonyultak, s a két "izomer" között semmi más különbséget nem találtak, csak azt, hogy az egyik jobbra forgat, a másik meg ugyanolyan mértékben balra. Minden olyan vegyület, amelynek molekuláiban a megállapított konstitúció tanúsága szerint az egy-egy szénatomhoz kapcsolódó atomok közül legalább kettô azonos (ill. legalább egy atom kettôs kötéssel kapcsolódik), optikailag inaktív. Ilyen esetekben nem volt tapasztalható izoméria sem, vagyis ilyen konstitúciónak mindig csak egy vegyület felelt meg.
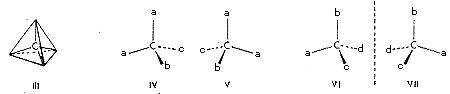
1. ábra
Az izomériaesetek egy csapásra értelmezhetôkké válnak, ha feltételezzük, hogy a szénatom négy vegyértéke egy olyan képzeletbeli tetraéder négy csúcsa felé mutat, amelynek középpontjában a szénatom ül (III), vagyis a molekulákban a szénatomokat úgy veszik körül a hozzájuk kapcsolódó atomok, mintha a szénatomok egy-egy, tetraéder középpontjában lennének, a négy-négy atom meg a tetraéderek csúcspontjain. A tetraéder nagyfokú szimmetriája azzal a következménnyel jár, hogy mindaddig, míg legalább két csúcsára azonos atom (vagy csoport) kerül akárhogy is változtassuk azok helyzetét mindig csak egyféle térszerkezetet kapunk (pl. IV és V), ha viszont mind a négy csúcspontjára más-más atom kerül, kétféle elrendezôdésre van lehetôség. A két elrendezôdés (VI és VII) tükörképe egymásnak, de egymással mégsem azonosak, nem hozhatók fedésbe (1. ábra). Egy szénatomot négy különbözô ligandum tehát kétféle elrendezôdésben, kétféle konfigurációban vehet körül. Az így létrejött molekulák nem szimmetrikusak; legalábbis a molekulaépítményen nem halad át olyan szimmetriasík, amely a molekulát két tükörképi félre osztaná. Ezért aztán a molekula nem azonos a saját tükörképével. Az olyan térbeli szerkezeteket, melyek tükörképükkel nem azonosak, általában királisnak nevezzük. A kifejezés a kéz görög nevébôl (kheir) jön, ugyanis a kéz is királis, hiszen a jobb és a bal kéz tükörképe egymásnak, de fedésbe nem hozhatók. A két azonos konstitúciójú királis molekulát, melyek egymás tükörképei, de egymással mégsem azonosak, entantiomereknek nevezzük. (Az említett szakkifejezések nem van't Hoff-tól származnak, hanem a sztereokémiában jelenleg használt általános fogalmak.) Foglaljuk össze a tetraéderes vegyértékorientáció eddig megtárgyalt következményeit. Ha a molekulában van egy olyan szénatom, mely minden vegyértékével más atomhoz vagy atomcsoporthoz kapcsolódik, akkor a molekula térszerkezetére két királis, egymással enantiomer viszonyban levô konfiguráció lehetôsége áll fenn. Ez a két lehetôség valósul meg a két izomer tejsavban, térszerkezetük most már jól megkülönböztethetô egymástól (VIII, ill. IX) (2. ábra).

2. ábra
A történeti hûség kedvéért a 3. ábrán bemutatjuk a van't Hoff elsô dolgozatában közölt tetraéderrajzokat, melyeket oly sok hasonló követett a kémiai tankönyvekben.
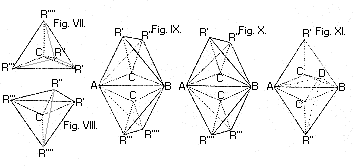
3. ábra
A vegyész nem kis elfogódottsággal néz ezekre az egyszerû ábrákra, melyek oly mélyen belevilágítottak, az anyag térbeli szervezôdésének törvényeibe. Ne akarjunk azonban többet kiolvasni belôlük, mint amennyit mondanak, amennyit egyáltalán mondhattak. Van't Hoff tudományos módszerében éppen az a zseniális, hogy egy kitûnô intuícióval felismert elv kimondásakor nem engedte szabadjára fantáziáját, nem mondott semmivel sem többet és részletesebbet a molekulák térszerkezetérôl, mint amennyit a tapasztalat, az ismert izomériajelenségek értelmezése megkövetelt. Ô csak azt állította, hogy a szén vegyértékorientációjának tetraéderes modellje megmagyarázza azt a tapasztalati tényt, hogy minden olyan vegyületbôl, melynek molekulájában elôfordul egy olyan szénatom, mely négy különbözô ligandumhoz kapcsolódik, két, de csakis két izomert találtak, ha viszont ilyen szénatom nincs a molekulában, akkor csak egyfélét. A tetraéderelv nemcsak egy lehetôség a tények értelmezésére, hanem az egyetlen egyszerû lehetôség. Ha más térbeli elrendezôdéseket veszünk alapul, akkor nemcsak négy különbözô ligandum esetén kapunk többféle szerkezeti lehetôséget, hanem más esetekben is, ill. a négy különbözô ligandum elrendezôdésére nemcsak két lehetôség adódik, hanem több is. A 4. ábra két-két azonos ligandum, ill. négy különbözô ligandum elrendezôdésének lehetôségét mutatja be olyan térszerkezet esetén, amikor a szénatom egy négyzet középpontjában, a ligandumok meg a négy csúcsponton helyezkednek el, valamennyi egy síkban. Látható, hogy ez a szerkezeti elv túl sok izomer lehetôségét jelentené, már pedig nincs jogunk feltételezni olyan izomerek lehetôségét, amilyeneket soha nem tapasztaltunk. Megjegyzendô, hogy a síkalkatú szerkezetek nem királisak.
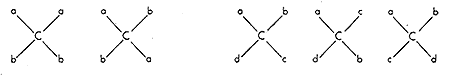
4. ábra
A tetraéderelmélet nem nyújt felvilágosítást az anyagok sokféle észlelt sajátsága és a molekulák feltételezett térszerkezete közti összefüggésrôl, csak a tapasztalt izomerekkel számol el. Ennél többet nem is várhatunk, hiszen a konstitúció is csak az "ahány különbözô anyag, annyi molekulaszerkezet" elvét elégítette ki. A tetraéderelv a konstitúció adta lehetôségeket a konfiguráció változataival toldotta meg, s ezzel az észlelt izomerek száma és a molekulaszerkezeti lehetôségek közti megfelelést állította helyre. Mégis óriási jelentôségû gondolatra hívta fel a figyelmet, amikor megmutatta, hogy az anyagok sokféleségével csak akkor tudunk elszámolni, ha a molekulák .térbeli felépítésének valamennyi lehetôségét figyelembe vesszük. Ez egyúttal azt jelenti, hogy az anyagok sajátságait a molekulák térbeli szerkezete szabja meg akkor is, ha nem tudjuk, hogyan.
| ChemoNet, 1998 Vissza |
http://www.kfki.hu/chemonet/ http://www.ch.bme.hu/chemonet/ |