Jean Perrin
(1870-1942)
Brown-mozgás és molekuláris valóság
(Részletek)
Annales de Chimie et de Physique, 8ème Series,
1909. szeptember
(Frederick Soddy fordítása alapján, in: Mary Jo
Nye: The Question of the Atom. From the Karlsruhe Congress to the First
Solvay Conference, 1860–1911, Tomash Publishers, Los Angeles/San Francisco,
1984)
 1.
A jelenség elsõ megfigyelése – Amikor egy
egyensúlyban lévõ fluid tömeget, például
egy pohár vizet tekintünk, a tömeg minden része
teljesen mozdulatlannak tûnik számunkra. Ha egy nagyobbb sûrûségû
tárgyat helyezünk bele, a tárgy esik benne, és
ha gömb alakú, pontosan függõlegesen esik. Igaz,
hogy az esés annál lassabb, minél kisebb a tárgy,
de amennyire látható, a tárgy esik, és ez mindig
azzal ér véget, hogy eléri az edény alját.
Ha az edény alján van, mint jól ismert, nem emelkedik
fel újra, s ez az egyik módja annak, hogy Carnot elve (a
másodfajú perpetuum mobile lehetetlensége) megnyilvánuljon.
1.
A jelenség elsõ megfigyelése – Amikor egy
egyensúlyban lévõ fluid tömeget, például
egy pohár vizet tekintünk, a tömeg minden része
teljesen mozdulatlannak tûnik számunkra. Ha egy nagyobbb sûrûségû
tárgyat helyezünk bele, a tárgy esik benne, és
ha gömb alakú, pontosan függõlegesen esik. Igaz,
hogy az esés annál lassabb, minél kisebb a tárgy,
de amennyire látható, a tárgy esik, és ez mindig
azzal ér véget, hogy eléri az edény alját.
Ha az edény alján van, mint jól ismert, nem emelkedik
fel újra, s ez az egyik módja annak, hogy Carnot elve (a
másodfajú perpetuum mobile lehetetlensége) megnyilvánuljon.
Ezek az ismerõs gondolatok azonban csak azon a méretskálán
érvényesek, amelyhez a szervezetünk hozzászokott,
és a mikroszkóp egyszerû használata elegendõ
ahhoz, hogy új gondolatok vetõdjenek fel, amelyek a fluid
állapot régi, statikus felfogását kinetikus
képpel helyettesítik.
Aligha vizsgálhatnánk sokáig a preparátumokat
egy folyékony közegben anélkül, hogy meg ne figyelnénk:
a folyadékban lévõ részecskék a sûrûségüknek
megfelelõ szabályos esés vagy emelkedés helyett
tökéletesen szabálytalan mozgást végeznek.
Jönnek-mennek, megállnak, újraindulnak, felemelkednek,
süllyednek,
újra
felemelkednek anélkül, hogy a legkisebb mértékben
törekednének a mozdulatlanságra. Ez a Brown-mozgás,
amelyet a természetbúvár Brown emlékére
neveztek el. Brown 1827-ben írta le
ezt a mozgást (nagyon röviddel az akromatikus objektív
felfedezése után), majd bebizonyította, hogy nem az
élõ állatkák következtében lép
fel, és felismerte, hogy a szuszpenzióban a részecskék
annál élénkebben keverednek, minél kisebbek.
2. A Brown-mozgás kivetítése – Ezt a jelenséget
kivetítéssel egy teremnyi hallgatóság is láthatja,
de a bemutatás nehéz, ezért hasznos lehet, ha részletesen
leírom azokat a fogásokat, amelyek hozzásegítettek
a kielégítõ eredményhez. Az elektromos ív
(vagy még jobb, ha a Nap) képe a preparátumban képzõdik,
és a nem világító hõsugarak nagyobbik
részét vízzel teli cella állítja meg.
A szuszpenzió részecskéirõl visszaverõdõ
fénysugarak, mint a közvetlen megfigyelés esetén,
egy immerziós objektíven és egy nagy nagyítású
okuláron haladnak át, majd egy totálreflexiós
prizmán vízszintesen térülnek el, hogy a szemcsék
képét csiszolt üvegbõl készült vetítõernyõn
jelenítsék meg, amelynek túlsó oldalán
van a hallgatóság (az üveg lehetõleg négyzethálós,
hogy vonatkoztatási alappal is szolgáljon). A fény
így jobban hasznosítható, mint a szokásos vetítõernyõ
esetén, amely a fény nagy részét olyan irányokba
szórná, ahol nincsenek megfigyelõk. A nagyítás
8000–10000 átmérõnyire növelhetõ.
Mindenekelõtt azonban megfelelõ emulziót kell készíteni.
Az eddigi néhány vetítési kísérletben
az alkalmazott szemcsék átmérõje mikronos nagyságrendû
volt, és 3 méteren túl a képük alig látszott
(legalábbis az ív fényével), akár immerziós,
akár oldalsó megvilágítást használtunk.
A kisebb szemcsék még kevésbé láthatók,
ami arra az elsõ látásra paradox konklúzióra
vezet, hogy a nagyobb szemcséket jobb kivetíteni, mint a
kicsiket. Igaz ugyan, hogy kevesebbet mozognak, de lényeges tulajdonságaik
gyors felismeréséhez ez is elegendõ.
Ugyancsak tudnunk kell, hogyan készítsünk több
mikron átmérõjû részecskéket,
és hamarosan látni fogjuk, hogy ezt a Brown-mozgás
kísérleti vizsgálatának több mozzanata
is megköveteli. Késõbb (a 32. pontban) megmutatom, hogyan
sikerült nagy, tökéletesen gömb alakú gumigutti-
és mézgaszemcséket elõállítani.
Ezekkel a szemcsékkel a Brown-mozgás a vetítõernyõtõl
még 8–10 méterre is látható a tökéletesen
elsötétített teremben.
3. A jelenség fellépése a fluidumon kívül
álló okok nélkül. Magyarázata a molekulák
mozgásával – A Brown által felfedezett meglepõ
jelenség nem keltett nagy érdeklõdést. Sõt
a fizikusok többsége sokáig elhanyagolta, és
feltételezhetõ, hogy azok, akik hallottak róla, azt
gondolták, hogy analóg azoknak a porrészecskéknek
a mozgásával, amelyeket a napsugárban táncolni
látunk a kis nyomás- és hõmérséklet-különbségek
miatt fellépõ enyhe légáramok hatására.
Amikor emlékeztetünk arra, hogy ez a látszólagos
magyarázat még mélyen gondolkozó elméket
is kielégített, csodálattal kell adóznunk azon
fizikusok éleslátása elõtt, akik ebben a kis,
mellékesnek tûnõ jelenségben az anyag egyik
alapvetõ tulajdonságát ismerték fel.
Mindamellett, mint oly gyakran, amikor a nagy rendezõelvek születését
kívánjuk felgombolyítani, nehezen állapítható
meg, hogy az a hipotézis, amely a Brown-mozgást a molekuláris
keveredésnek tulajdonítja, hogyan is jelent meg pontosan
elõször és hogyan fejlõdött.
Az elsõ név, amelyre e tekintetben hivatkoznunk kell,
talán a Weineré, aki megfigyelései alapján
kijelentette, hogy a mozgás nem lehet konvekciós áramok
következménye, hanem okát magában a folyadékban
kell keresni, és aki végül, csaknem akkor, amikor a
hõ kinetikus elméletének kidolgozása elkezdõdött,
megsejtette, hogy a molekuláris mozgások magyarázatot
adhattak a jelenségre.[1]
Néhány évvel késõbb Delsaulx és
Carbonnelle atya a Royal Microscopical Society és a Revue
des Questions scientifiques címû folyóiratban
1877 és 1880 között több jegyzetet közölt
a Brown-mozgás termodinamikai eredetérõl.[2]
Delsaulx
atya egyik jegyzetében például ezt olvashatjuk:
"a folyadékok szuszpenzióiban levõ kis részecskék
keveredése valóban általános jelenség",
és "ezért természetes, hogy egy ilyen általános
jelenséget az anyag általános tulajdonságának
tekintsünk", és "így azok a belsõ transzlációs
mozgások, amelyek a gázok, gõzök és folyadékok
hõállapotát alkotják, nagyon jól megmagyarázhatják
a megfigyeléseket."
Carbonnelle atya egyik jegzetében pedig ez áll: "Adott
területû felület esetében a folyadék molekuláris
ütközései, amelyek a nyomást okozzák, a
szuszpendált részecskék semmilyen perturbációját
nem idézik elõ, mert ezek, összességükben,
minden irányban egyformán ösztökélik a részecskéket.
De ha ennek a felületnek a területe kisebb, mint amekkora a szabálytalanságok
kiegyenlítéséhez szükséges, semmilyen
alap nincs az átlagos nyomás megállapítására;
fel kell ismerni, hogy az egyenlõtlen nyomás helyrõl
helyre változik, mert a nagy számok törvénye
nem vezet már egyenletességhez, s az eredõ most nem
zérus lesz, hanem irányát és nagyságát
tekintve is állandóan változik. Minél kisebb
testet tételezünk fel, az egyenlõtlenségek annál
nyilvánvalóbbá válnak, és emiatt az
oszcillációk is egyre élénkebbek lesznek. ..."
Ezeket a fontos gondolatokat sajnos ugyanolyan kevéssé
ismerték, mint Weiner fejtegetéseit. Mindamellett úgy
tûnik, hogy nem kísérte õket olyan kísérlet,
amely elegendõ lett volna a korábban jelzett felületes
magyarázat elvetésére, így a javasolt elméletet
azok sem fogadták el, akik megismerték.
Csak Gouy úr munkája szögezte le (1888-ban), hogy
a molekuláris keveredés hipotézise nemcsak elfogadható
magyarázatot ad a Brown-mozgásra, hanem a mozgás okaként
más el sem képzelhetõ, ami különösen
megnövelte a hipotézis jelentõségét.[3]
A dolgozat azonnal erõteljes visszhangot váltott ki, és
a Brown-mozgás ekkor foglalta el helyét az általános
fizika fontos problémái között.
Gouy úr elõször is megfigyelte, hogy a Brown-mozgást
nem a vizsgált folyadéknak átadott rezgések
váltják ki, mert éjszaka vidéken, az altalajon
ugyanúgy megfigyelhetõ, mint nappal egy forgalmas utcán,
ahol nehéz jármûvek közlekednek. Azok a konvekciós
áramok sem keltik, amelyek a fluidumokban lépnek fel a termikus
egyensúly beállta elõtt, mert a Brown-mozgás
nem változik észrevehetõen akkor sem, ha az egyensúly
eléréséhez bõséges idõ áll
rendelkezésre. Ezért a Brown-mozgás és a napfényben
táncoló porrészecskék keveredése közötti
mindennemû összehasonlítást félre kell
tenni. Ezenkívül az utóbbi eseteben könnyen látható,
hogy a szomszédos porrészecskék általában
azonos irányban mozognak és nagyjából annak
a közös áramnak az alakját követik, amely
hordozza õket, míg a Brown-mozgásnak az a legmeglepõbb
vonása, hogy még az olyan szomszédos részecskék
elmozdulásai is teljesen függetlenek egymástól,
amelyek közvetlenül egymás mellett haladnak el. Végül
a preparátum elkerülhetetlen megvilágítása
sem okolható, mert Gouy úr ezerszer csökkentette hirtelen
a fényt vagy változtatta meg jelentõsen a színét
anélkül, hogy bármilyen változást idézett
volna elõ a jelenségben. Az idõrõl idõre
felvetett többi oknak is ugyanígy nincs hatása, és
úgy tûnik, még a részecskék természetének
sincs semmilyen jelentõsége, ezért nehéz nem
elhinni, hogy ezek a szemcsék egyszerûen a fluidum belsõ
keveredésének megismerésében segítenek,
annál jobban, minél kisebbek, mint ahogy a parafa dugó
is jobban követi a tenger hullámait, mint a nagy hajó.
Nyilvánvaló tehát, hogy amikor egyensúlyban
lévõ fluidumról beszélünk, állandó
és alapvetõ tulajdonságra utalunk. Ez az egyensúly
csak átlagként és nagy tömegek esetén
létezik; statisztikai egyensúly. A valóságban
az egész fluidum meghatározatlan és spontán
módon keverik mozgások által, és a fluidumnak
minél kisebb részletét tekintjük, a keveredés
annál élénkebb és gyorsabb; az egyensúly
statisztikus fogalma illuzórikus.
4. A Brown-mozgás és a Carnot-elv – Létezik
tehát egy végtelen, külsõ ok nélkül
fenntartott keveredés. Nyilvánvaló, hogy ez a keveredés
nincs ellentmondásban az energiamegmaradással. Elegendõ,
ha egy szemcse minden sebességnövekedését a folyadék
lehûlése kíséri a szemcse közvetlen környezetében,
s ugyanígy minden sebességcsökkenés lokális
felmelegedéssel jár együtt, energiaveszteség
vagy -felvétel nélkül. Felismerjük, hogy a termikus
egyensúly is egyszerûen statisztikus egyensúly. De
meg kell jegyezni, és ez az igen fontos gondolat szintén
Gouy úrtól származik, hogy a Brown-mozgás nem
összeegyeztethetõ azokkal a merev kijelentésekkel, amelyeket
oly gyakran hangoztatnak a Carnot-elv alapján; a kiválasztott
kijeletésrõl megmutatható, hogy nincs jelentõsége.
Például egyensúlyban levõ vízben szemmel
követhetünk egy víznél nagyobb sûrûségû
részecskét, és láthatjuk, hogy bizonyos idõpontokban
magától felemelkedik, miközben szükségképpen
munkát vesz fel a környezõ közeg hõjének
rovására. Ezért nem mondhatjuk többé,
hogy lehetetlen a másodfajú perpetuum mobile, hanem azt kell
mondanunk, hogy "azon a méretskálán, amely bennünket
gyakorlatilag érdekel, a másodfajú perpetuum mobile
jelensége olyan lényegtelen, hogy figyelembevétele
abszurdum lenne". Másrészt ezeket a korlátokat már
régen megfogalmazták: Clausius, Maxwell, Helmholtz, Boltzmann
és Gibbs is úgy gondolta, hogy a Carnot-elv közelítõ
törvényt fejez ki. Idézzük csak fel a Maxwell-démont,
amely elég gyors lévén ahhoz, hogy a molekulákat
egymástól megkülönböztesse, tetszés
szerint hõt áramoltathat át munka nélkül
a hideg részbõl a melegbe. De mivel a molekulák láthatatlanok,
létük tagadásával a tökéletesen merev
Carnot-elvben is hihettek. Ez azonban nem engedhetõ meg ezentúl,
mert ez a merevség ellentmondásban áll a kézzelfogható
valósággal.
Másrészt a Carnot-elv gyakorlati fontosságát
nem éri támadás, és aligha kell hosszan bizonygatnom,
milyen oktalan lenne, ha a Brown-mozgással akarnánk felemeltetni
azokat a köveket, amelyeket a házépítéshez
szánunk. De ez a fontos elv igen mély jelentésre tesz
szert: az anyagszerkezettel való kapcsolata érthetõbbé
válik, és arra a megállapításra jutunk,
hogy a molekuláris mozgások spontán koordinációja
annál valószínûtlenebb, minél nagyobb
a molekulaszám és minél hosszabb a megfigyelési
idõ.[4]
5. A kinetikus molekuláris hipotézis – Azt mondtam,
hogy Gouy úr és követõinek elmélete a
Brown-mozgást a fluidum molekuláinak szüntelen mozgásával
magyarázza; ezek a molekulák szüntelenül lökdösik
a megfigyelt részecskéket, szabálytalanul mozgatják
õket a fluidumban kivéve akkor, amikor ezek az ütközések
kiegyenlítik egymást. Nemcsak azt ismerték már
fel régen – különösen a diffúziós megfigyelések,
valamint a mozgás hõvé való átalakulásának
magyarázatakor –, hogy az anyagok homogén megjelenésük
ellenére különálló molekulákból
állnak, hanem azt is, hogy ezek a molekulák szüntelen
keveredésben vannak, ez fokozódik a hõmérséklet
emelkedésével, és csak az abszolút nulla fokon
szûnik meg.
Ahelyett, hogy ezt a hipotézist adottnak tekintenénk,
és megnéznénk, hogyan ad számot a Brown-mozgásról,
jobbnak tûnik bemutatni, amennyiben lehetséges, hogy a hipotézis
ebbõl a jelenségbõl következik logikusan, s erre
kísérletet is tennék.
A Brown-mozgásban az az igazán furcsa és új,
hogy soha nem áll meg. Elsõre úgy tûnik, hogy
ez ellentmondásban van a súrlódás mindennapi
tapasztalatával. Ha például egy vödör vizet
öntünk egy kádba, természetesnek tûnik, hogy
egy kis idõ múlva a folyékony tömeg mozgása
eltûnik. Elemezzük tovább, hogyan jutunk el ehhez a nyilvánvaló
egyensúlyhoz: elõször minden részecske sebessége
csaknem egyenlõ és párhuzamos; de ez a koordináció
azonnal sérül, amint néhány részecske,
amely a kád falába ütközik, megváltozott
sebességgel verõdik vissza minden irányba, és
hamarosan újra eltérül a folyadék többi
részével ütközve. Tehát az esés után
néhány pillanattal a víz minden része még
mozgásban lesz, de most nagyon kis részét kell tekinteni
ahhoz, hogy különbözõ pontjainak sebességei
körülbelül ugyanazt az irányt és értéket
vegyék fel. Ez könnyen nyomon követhetõ, ha színes
porokat keverünk egy folyadékba: egyre szabálytalanabb
relatív mozgásokat látunk.
Amíg bármit is meg tudunk különböztetni,
nem a mozgások megszûnését, hanem egyre kaotikusabbá
válását észleljük, és a porok
annál szabálytalanabbul keverednek egymással, minél
kisebbek a szemcsék.
A koordinációnak ez a megszûnése a végtelenségig
tart?
Hogy a kérdésre válaszolhassunk, és ezt
a dekoordinálódást minél tovább nyomon
követhessük azután is, hogy puszta szemmel nem látjuk
már, a mikroszkópot hívhatjuk segítségül,
és a mozgás jelzésére mikroszkopikos porokat
használhatunk. Éppen ilyen körülmények között
észlelhetõ a Brown-mozgás: kiderül, hogy a dekoordinációs
mozgás, amely megfigyeléseink közönséges
skáláján olyan nyilvánvaló, nem folytatódik
a végtelenségig, és a mikroszkópos megfigyelés
skáláján egyensúlyt állapítunk
meg a koordináció és a dekoordináció
között. Ha, mondjuk, bizonyos jelzõszemcsék minden
egyes pillanatban megállnak, ugyanebben a pillanatban más
tartományokban van néhány szemcse, amelynek mozgása
automatikusan újrakoordinálódik, mert ezek a szemcsék
felveszik azoknak a sebességét, amelyek megálltak.
Ezért úgy tûnik, nem szabadulhatunk az alábbi
konklúziótól.
Abból, hogy egy fluidumban a mozgás szétoszlása
nem folyik a végtelenségig, és spontán rekoordináció
korlátozza, az következik, hogy a fluidumok maguk is szemcsékbõl
vagy molekulákból állnak, amelyek egymáshoz
képest minden lehetséges mozgást felvehetnek, de amelyek
belsejében a mozgás szétoszlása nem lehetséges.
Ha ezek a molekulák nem léteznének, nem világos,
hogy miként korlátozhatnák bármennyire is a
mozgás dekoordinálódását.
Ezzel szemben, ha ezek a molekulák léteznek, szüntelenül
részleges újrakoordinálódás játszódik
le; ha egymás közelében haladnak el, befolyásolják
az újrakoordinálódást (ütközéssel
vagy bármely más módon), a molekulák sebességégének
nagysága és iránya folyton módosul, és
ezek a változások néha odavezetnek, hogy a szomszédos
molekulák egyezõ mozgást végeznek. Sõt
anélkül, hogy ez az abszolút megegyezés szükségessé
válna, elég gyakran elõfordul, hogy egy jelzõrészecske
tartományában a molekulák egy bizonyos irányban
annyi többletmozgást vesznek fel, amennyi elegendõ ahhoz,
hogy ezt a részecskét ebbe az irányba mozgassák.
A Brown-mozgás állandó hõmérsékleten
állandó: ez kísérleti tény. Tehát
a molekuláris mozgás, amelyet ez alapján elképzelünk,
szintén állandó. Ha ezek a molekulák úgy
ütköznek, mint a billiárdgolyók – hozzá
kell tennünk, hogy a molekulák tökéletesen rugalmasak
–, ez a kijelentés azt mutatja, hogy egy termikusan szigetelt rendszer
molekuláris ütközései során a mozgási
energiák összege állandó marad.
Röviden, a Brown-mozgás vizsgálata önmagában
elegendõ ahhoz a feltevéshez, hogy minden fluidum rugalmas
molekulákból áll, amelyek állandó mozgásban
vannak.
6. Az atomok. Az Avogadro-állandó – Ebbõl,
mint jól ismert, többféle kémiai megfigyelés,
és különösen a szubsztitúció vizsgálata
az atomok létezésének fogalmához vezet. Ha
például kalciumot oldanak fel vízben, csak a vízben
levõ hidrogén fele helyettesítõdik. Ezért
a víz hidrogénje, következésképp minden
molekula hidrogénje két különálló
részbõl áll. Semmilyen kísérlet nem
vezet további differenciáláshoz, ezért ez a
két rész az összes kémiai módszererrel
oszthatatlannak tekinthetõ, egyszóval atom. Másrészt
a víz összes tömege és ezért egy molekula
víz is 9-szer akkora súlyú, mint amennyi hidrogént
tartalmaz: tehát a vízmolekula, amely 2 atom hidrogént
tartalmaz, 18-szor akkora súlyú, mint a hidrogénatom.
Hasonlóképpen megállapítható, hogy például
a metánmolekula 16-szor nehezebb a hidrogénatomnál.
Tehát pusztán kémiai módszerrel, az atom fogalmának
felhasználásával, megállapítható,
hogy a metán- és a vízmolekula súlyának
aránya 16/18.
Mármost pontosan ugyanez az arány adódik, ha hasonló
térfogatú metán és vízgõz tömegét
vetjük össze gáz halmazállapotban hasonló
hõmérséklet és nyomás mellett.
Így ennek a két tömegnek, amelynek aránya megegyezik
a kétféle molekula tömegének arányával,
ugyanannyi molekulát kell tartalmaznia. Ez az eredmény általánosan
érvényes a különbözõ gázokra,
így következésképp, kísérleti úton,
ahhoz a híres állításhoz vezet, amelyet egy
századdal ezelõtt Avogadro hipotézisként
fogalmazott meg, majd egy kicsit késõbb Ampère
is felvetett:
"Bármely két gáz, azonos hõmérséklet
és nyomás esetén, azonos térfogatban azonos
számú molekulát tartalmaz."
Egy anyag gramm-molekulasúlynyi mennyiségének nevezik
szokás szerint az anyag azon tömegét, amely gáz
halmazállapotban ugyanakkora térfogatot foglal el, mint 2
gramm hidrogén azonos hõmérsékleten és
nyomáson mérve. Avogadro állítása ekkor
a következõvel ekvivalens:
"Bármely két anyag gramm-molekulasúlyi mennyisége
azonos számú molekulát tartalmaz."
Ez az állandó N szám univerzális állandó,
és helyénvaló, ha Avogadro-állandónak
nevezzük. Ha ezt az állandót tudjuk, bármely
molekula tömegét is tudjuk: sõt bármely atom
tömegét is megtudhatjuk, mert a kémiai képletekhez
vezetõ különbözõ módszerekkel megállapíthatjuk,
hogy az egyes molekulák hányat tartalmaznak az egyes atomokból.
Például egy molekula víz súlya 18/N, egy molekula
oxigéné 32/N, és így tovább minden molekulára.
Ennek megfelelõen az oxigénatom súlya úgy számítható
ki, ha az oxigén grammatomsúlynyi mennyiségének
súlyát elosztjuk N-nel, tehát 16/N, a hidrogénatomé
1,008/N, és így tovább minden atomra.
7. A molekulaenergia-állandó – Könnyen belátható,
hogy az Avogadro-állandó ismeretében kiszémíthatjuk
a különbözõ molekulák átlagos transzlációs
kinetikus energiáját, s ennek következtében ez
az energiaérték megadja nekünk N-et. Vizsgáljuk
meg egy kicsit ezt a fontos kérdést.
Ha a fluidumok mozgó molekulákból állnak,
a tágulásukat korlátozó felületekre kifejtett
nyomásukat annak tulajdoníthatjuk, hogy molekuláik
ezekbe a felületekbe ütköznek, és gázok esetén
(amikor a molekulák viszonylag távol vannak egymástól)
Joule, Clausius és Maxwell egymást követõ megállapításainak
és módosításainak köszönhetõen
megállapítást nyert, hogy ez a felfogás a következõ
pontos összefüggést tartalmazza:
pv = 2/3 (nw),
ahol p az a nyomás, amelyet n darab, w átlagos
kinetikus energiájú molekula v térfogatban
létrehoz.
Egy gramm-molekulasúlynyi gáz esetén n megegyezik
N-nel, pv pedig RT-vel, ahol T az abszolút hõmérséklet
és R a tökéletes gázokra vonatkozó
gázállandó (cgs egységben 83,2 ·106).
Ekkor az elõzõ egyenlet a következõ alakot ölti:
2/3 (Nw) = RT
vagy
w = 3RT/(2N).
Mármost az N állandó minden anyagra ugyanaz. Ezért
az összes gáz esetében a transzláció molekuláris
kinetikus energiájának átlagértéke azonos,
és arányos az abszolút hõmérséklettel:
w = aT.
Az a állandó, amelyet molekulaenergia-állandónak
nevezhetünk, 3R/(2N), és N-hez hasonlóan univerzális
állandó.
Nyilvánvaló, hogy a két állandó bármelyike
ismert, ha az egyiket meghatározzuk.
...
14. A gáztörvények kiterjesztése a híg
emulziókra – Tegyük fel, hogy készíthetünk
olyan emulziót, amelyben minden szemcse azonos; a rövidség
kedvéért ezt az emulziót egyenletesnek fogom
nevezni. Elsõre, intuitíve, úgy tûnik, hogy
az ilyen emulziók szemcséinek ugyanúgy kell eloszlaniuk
a magasság függvényében, mint a gázmolekuláknak
a gravitáció hatására. Amint a levegõ
sûrûbb a tenger szintjénél, mint egy hegytetõn,
az emulzió szemcséi, a kezdeti eloszlástól
függetlenül, szintén állandó állapotot
vesznek fel, amelyben a koncentráció az alsóbb rétegektõl
mért magasság függvényében csökken,
és a hígulás törvénye ugyanolyan, mint
a levegõ esetében.
A részletes vizsgálat alátámasztja ezt az
elképzelést, és a hígulás törvényét
precíz okfejtéssel állapítja meg nagyon hasonlóan
ahhoz, ahogyan Laplace állapította meg a magasság
és a barometrikus nyomás közötti kapcsolatot.
Képzeljünk el egy egyensúlyi állapotban levõ,
egyenletes emulziót, amely s keresztmetszetû függõleges
hengert tölt meg. A h és h + dh szint
közötti vízszintes szelet állapota nem változna,
ha két olyan dugattyú közé zárnánk
be, amelyek átengedik a vízmolekulákat, de nem engedik
át a szemcséket (a pergamenpapír vagy kollódiummembrán
megfelelõ). Ezekre a félig áteresztõ dugattyúkra
a szemcsék ütközése és az ozmózisnyomás
hat. Ha az emulzió híg, a nyomás ugyanolyan meggondolással
számítható ki, mint a gázok vagy a híg
oldatok esetében, vagyis ha a h szinten n szemcse
van egységnyi térfogatban, a P ozmózisnyomás
1/3nW, ahol W jelöli az átlagos szemcseenergiát,
és a h + dh szinten 2/3(n+dn)W. Mármost
a vizsgált szelet nem esik lefelé: ehhez az szükséges,
hogy egyensúly alakuljon ki a szeletet felfelé hajtó
ozmózisnyomás-különbség és a folyadék
felhajtóerejével csökkentett teljes részecskesúly
között, amely lefelé nyomja a szeletet. Ezért,
ha az egyes szemcsék térfogata
f,
sûrûsége D, a szemcsék
közötti folyadék sûrûsége
d,
azt kapjuk, hogy
–(2/3)sW dn = ns dh
f(D-d)g ,
vagy
–(2/3)W dn/n = f(D-d)g
· dh,
ami egyszerû integrálás után a következõ
összefüggést adja két, egymástól
h
szintkülönbségû pont n0 és
n
koncentrációjára:
(2/3)W log (n0/n) = f(D-d)gh.
Ez az összefüggést az emulzió eloszlási
egyenletének nevezhetjük. Világosan megmutatja,
hogy az egyenletes emulzió szemcséinek koncentrációja
exponenciális csökken a magasság függvényében
ugyanúgy, mint a barometrikus nyomás a magasság függvényében.[5]
Ha az egyenlet W-tõl különbözõ paraméterei
megmérhetõk, láthatjuk, hogy az egyenlet igazolható-e
és a W-re kapott eredmény megegyezik-e a molekulaenergiának
tulajdonított értékkel. Ha igen, a Brown-mozgás
eredete megállapítás nyer, és a gáztörvények,
amelyeket van't Hoff az oldatokra már
kiterjesztett, látható szemcséket tartalmazó
emulziók esetén is érvényesnek tekinthetõk.
15. A vizsgálatokhoz alkalmas emulziók – A korábbi
kísérletek semmilyen információt nem adnak
az emulziók szemcséinek egyensúlyi eloszlásáról.
Mindössze annyi ismert, hogy számos kolloid oldat felsõ
része kitisztul, ha több hétig vagy hónapig nem
zavarják fel.
Ezekkel a kolloid oldatokkal (arzén-szulfát, vas(III)-hidroxid,
kollargol stb.) eredménytelenül próbálkoztam.
Másrészt, némi kísérletezés után
méréseket tudtam végezni a gumigutti-, majd (Dabrowski
úr segítségével) a mézgaemulziókkal.
A vízfestékhez használt gumiguttit a Garcinia
morella (az indokíniai guttier) latexének kiszárításával
állítják elõ. Ha ebbõl az anyagból
egy darabot kézzel desztillált víz vékony rétege
alatt dörzsölgetünk (ahogy a szappant a szappanlé
képzõdésekor), lassanként feloldódik
és gyönyörû, élénksárga, átlátszatlan
emulziót képez, amely mikroszkóppal nézve különbözõ
méretû, tökéletesen gömb alakú sárga
szemcsék sokaságából áll. Ezek a sárga
szemcsék erõteljes centrifugálással ugyanúgy
elválaszthatók a folyadéktól, ahogy a vörösvértestek
a vérszérumtól. A centrifugaedény alján
sárga iszapként gyûlnek össze, és a zavaros
folyadék leönthetõ róluk. Ha a sárga iszapot
(rázogatva) újból felhígítjuk desztillált
vízzel, törzsemulziót kapunk, amelybõl a mérésekhez
szükséges egyenletes emulziókat elkészíthetjük.
...
...
18. A kísérleti elrendezés – Bizonyára
érthetõ, hogy az emulziók egyensúlyi eloszlását
nem néhány centiméter vagy akár milliméter
magasságban tanulmányoztam, hanem egy vékony preparátumot
készítettem a mikroszkópos vizsgálathoz, ahogy
a diagram vázolja (1. ábra).
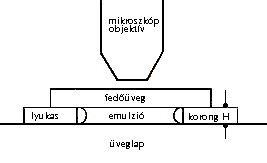
1. ábra
Képzeljük el, hogy egy lyukas, nagyon vékony üveglemez
van egy üveglapra ragasztva. Ez olyan alacsony, hengeres edényt
képez, amelynek H magassága körülbelül 100
m
(0,1 mm).[6]
Ennek az edénynek a közepére teszünk egy csepp
emulziót, majd azonnal elsimítjuk a fedõüveggel;
ez utóbbi, mely a perforált üveglemez felsõ lapjához
ragad, teljesen lezárja a cellát. A párolgás
megakadályozása érdekében a fedõlap
széleit paraffinnal vagy lakkal fedjük be, így a preparátumot
napokig vagy akár hetekig vizsgálhatjuk.
A preparátumot egy jó mikroszkóp tárgyasztalára
helyezzük, amelyet gondosan vízszintesre állítottunk.
Az igen nagy nagyítású objektívnek kicsi a
fókusztávolsága, és egyszerre csak azok a szemcsék
láthatók tisztán, amelyek egy nagyon vékony,
vízszintes rétegben vannak; ennek vastagsága egy mikron
nagyságrendû. A mikroszkóp emelésével
vagy süllyesztésével egy másik réteg látható.
E két réteg függõleges távolsága
annak a h magasságnak felel meg, amely az eloszlási
egyenletben szerepel; értékét pontosan kell ismerni.
Úgy kapjuk meg, ha a mikroszkóp h' elmozdulását
megszorozzuk annak a két közegnek a relatív törésmutatójával,
amelyet a fedõüveg elválaszt egymástól.
Mivel a szemcsék közötti folyadék víz, h
egyenlõ (4/3)h'-vel, ha száraz objektívet
használunk, és h'-vel, ha vízimmerziót
alkalmazunk, amihez igen gyakran folyamodtam. A h' elmozdulás
közvetlenül leolvasható arról a lemezrõl,
amely a mikroszkóp mozgását kiváltó
mikrométercsavarhoz van rögzítve (a Zeiss-mûszer
legalább negyedmikronos pontossággal olvasható le).
19. A szemcsék számlálása – Szükségünk
van arra is, hogy két különbözõ szinten meghatározzuk
a szemcsék koncentrációjának n0/n
arányát. Ez az arány nyilvánvalóan a
két szinten látható szemcsék számának
az aránya. Ezeket a számokat kell meghatározni.
Elsõ látásra ez nem könnyû feladat:
nem álló objektumokat kell megszámolni, és
ha a szemünket a mikroszkópra helyezzük, s néhány
száz szemcsét látunk minden irányban mozogni,
emellett a szemcsék állandóan eltûnnek, miközben
újak jelennek meg, hamarosan minden olyan kísérletet
értelmetlennek tartunk, amely akár csak durván megbecsülné
a szemcsék számát a vizsgált rétegben.
Az látszik a legegyszerûbbnek, ha pillanatfelvételeket
készítünk errõl a rétegrõl, hogy
megkapjuk az ott levõ szemcsék éles képét,
és ha az emulzió olyan híg, hogy a szám kicsi,
addig ismételjük az eljárást, amíg a lemezen
levõ részecskék átlagos számát
tetszõleges, például 1 százalékos pontossággal
nem ismerjük. Viszonylag nagy szemcsék esetében ezt
a módszert alkalmaztam, amint a késõbbiekben kitûnik.
0,5
m-nál kisebb átmérõjû
szemcsék esetében nem tudtam jó felvételeket
készíteni, és a következõ módszerhez
kellett folyamodnom: az okulár fókuszsíkjába
olyan átlátszatlan fóliát helyeztem, amelyen
egy tûvel apró, kerek lyukat ejtettem. A látótér
így nagyon lecsökken, és a szem egy pillantás
alatt fel tudja mérni azoknak a szemcséknek a pontos számát,
amelyek egy adott pillanatban láthatók; ezt az idõtartamot
egy rövid jel vagy egy rövid megvilágítási
periódus határozza meg, amelyet fényképészeti
zárral idézhetünk elõ. A vizsgálathoz
az szükséges, hogy a szemcsék száma ne legyen
több 5-nél vagy 6-nál.
Szabályos idõközönként, például
15 másodpercenként végezve a megfigyeléseket,
egy számosrt kapunk; ennek átlaga egyre inkább megközelít
egy határt, amely megadja a szemcsék átlagos gyakoriságát
a kis hengernek abban a rétegében, amelyre a mikroszkópot
beállítottuk. Egy másik szintre áttérve
újra meghatározzuk az átlagos gyakoriságot
ugyanerre a térfogatra, és ennek a két számnak
a hányadosa adja meg a keresett koncentrációk arányát.
Ahelyett, hogy minden leolvasást folyamatosan egy szinten végeznénk,
a leolvasásokat célszerûbb váltogatni, például
100-at végzünk az egyik szinten, megint 100-at egy másikon,
ismét 100-at az elsõn és így tovább.
Valamelyes pontossághoz több ezer leolvasás szükséges.
Példaként idemásoltam 50 egymás utáni
leolvasás eredményét az egyik emulzió két,
egymástól 30 m-ra levõ
szintjén:
| 3 |
2 |
0 |
3 |
2 |
2 |
5 |
3 |
1 |
2 |
| 3 |
1 |
1 |
0 |
3 |
3 |
4 |
3 |
4 |
4 |
| 0 |
3 |
1 |
3 |
1 |
4 |
2 |
2 |
1 |
3 |
| 1 |
1 |
2 |
2 |
3 |
0 |
1 |
3 |
4 |
3 |
| 0 |
2 |
2 |
1 |
0 |
2 |
1 |
3 |
2 |
4 |
az alsó szinten és
| 2 |
1 |
0 |
0 |
1 |
1 |
3 |
1 |
0 |
0 |
| 0 |
2 |
0 |
0 |
0 |
0 |
1 |
2 |
2 |
0 |
| 2 |
1 |
3 |
3 |
1 |
0 |
0 |
0 |
3 |
0 |
| 1 |
0 |
2 |
1 |
0 |
0 |
1 |
0 |
1 |
0 |
| 1 |
1 |
0 |
2 |
4 |
1 |
0 |
1 |
0 |
1 |
a felsõ szinten.
...
23. A Brown-mozgás oka valóban a molekulák keveredése[7]
– Mivel két pont esetén a pontokhoz tartozó koncentrációk
aránya csak a pontok közötti függõleges távolságtól
függ, a 14. és 15. pontban megállapított
eloszlási egyenlet,
2,303 W log10 n0/n
= 2pa3(D-d)gh,
minden emulzió esetén jól definiált értéket
ad a W szemcseenergiára*. Ha a kinetikus
elmélet teljesen egzakt, ez az érték nem függ
a választott emulziótól, és egyenlõ
bármely, azonos hõmérsékletû molekula
w
átlagos energiájával. Vagy, ami ugyanaz, a 3/2(RT/W)
kifejezésbõl származó N' független a vizsgált
szemcsék sugarától és sûrûségétõl,
és egyenlõ a 3/2(RT/w) kifejezéssel, vagyis
az Avogadro-állandóval (7. pont), amelynek egyik közelítését
már ismerjük (11. pont). Ezzel ekvivalens annak a vizsgálata,
hogy különbözõ emulziók esetén N' a
Van der Waals-egyenletnek megfelelõ 60·1022 érték
közelébe esik-e.
[A különbözõ szemcseméretû emulziókkal
kapott értékek 50·1022 és 80·1022
közé estek.]
A fönti sorozatból kapott szemcseenergia-értékek
a kísérleti hibák határian belül egybeesnek,
noha a szemcsék tömege 1:40 arányban, a szemcsék
és a közeg sûrûsége 1:4,7 arányban,
a hígulás a magasság függvényében
1:30 arányban változott. Ebben a hamarosan tágítandó
körben mellesleg kísérletileg igazoltuk a különbözõ
tömegek közötti egyenletes energiaeloszlást.
De az is nyilvánvaló, hogy ezek az értékek
egybeesnek a molekulaenergiára jósolt értékkel.
Az átlagos eltérés nem haladja meg a 15 százalékot,
s a Van der Waals-egyenletbõl adódó szám nem
éri el ezt a pontosságot.
Nem hiszem, hogy ez az egyezés bárminemû kétséget
hagyhat a Brown-mozgás eredetét illetõen. Az eredmény
meglepõ voltának megértéséhez fel kell
elevenítenünk, hogy a kísérlet elõtt senki
sem merte volna állítani, hogy a koncentrációcsökkenés
ne lenne elhanyagolható néhány mikronnyi magasságkülönbségen,
vagy, ellenkezõleg, senki sem merte volna állítani,
hogy az összes szemcse ne érkezne meg végül az
edény aljának közvetlen szomszédságába.
Az elsõ hipotézis esetén az N' értékére
zérus
adódna, a második esetében végtelen.
Az, hogy abban az óriási intervallumban, amely N' számára
a
priori lehetségesnek tûnik, a talált szám
ilyen pontosan megközelíti a jósolt értéket,
biztosan nem tekinthetõ véletlen eredménynek.
Tehát elmondhatjuk, hogy a Brown-mozgás molekuláris
elmélete kísérleti igazolást nyert, és
ugyanakkor igen nehézzé vált a molekulák
objektív valóságának tagadása. Azt
is látjuk egyszersmind, hogy a gáztörvény, amelyet
van't
Hoff kiterjesztett a híg oldatokra, az egyenletes emulziókra
is kiterjeszthetõ. A Brown-mozgás egy másik skálán
ad hû képet – például – egy tó vizében
feloldott oxigénmolekulák mozgásáról,
amelynek során az egymással csak ritkán találkozó
oxigénmolekulák az oldószermolekulákkal ütközve
változtatják irányukat és sebességüket.
...
24. Az Avogadro-állandó pontos meghatározása
– Felidézve, hogy az egyenlõ szemcsék a híg
emulzióban úgy oszlanak el, mint a tökéletes
gázok törvényének engedelmeskedõ nehéz
molekulák, eloszlási egyenletük, amelyben most W helyébe
(3/2)RT/N írható, a következõ alakot ölti:
2,303 RT/N log10 n0/n
= (4/3) pa3g(D-d)h
.
Ugyanez az egyenlet szolgálhat az N állandó és
az ettõl függõ állandók meghatározására,
és úgy tûnik, hogy az N korlátlan pontosságal
határozható meg. Az egyenletes emulzió elkészítése
és az egyenlet N-tõl eltérõ paramétereinek
meghatározása a valóságban tetszõleges
pontosságot érhet el. Ez egyszerûen türelem
és idõ kérdése; semmi sem korlátozza
a priori az egyenletek pontosságát, és az atom
tömege, ha igény van rá, ugyanolyan pontossággal
meghatározható, mint a Földé. Aligha kell megjegyeznem
másrészt, hogy még a tökéletes kompresszibilitásmérések
sem tehetnek semmit azért, hogy N értékének
bizonytalansága akár talán a 40 százalékot
is elérje, amikor N-et a Van der Waals-egyenletbõl vezetjük
le olyan hipotézisek segítségével, amelyekrõl
biztosan tudjuk, hogy nem teljesen pontosak.[8]
Öt, korábban leírt kísérletsorozat
N értékére durva átlagként 69·1022-t
ad, a sorozat leggondosabb kísérletében mézgát
használtunk (fényképészeti lemezzel készítve
felvételt), és az eredmény 70·1022
volt.
Már többször kitértem rá, hogy gumiguttival
is mértem egy sorozatot, és ennek eredményét
még mindig jóval pontosabbnak tartom. Az emulzió szemcséinek
átlagos sugara 0,212 m-nak adódott
11000 szemcse megszámlálásával és 0,213
m-nak
a Stokes-törvény alkalmazásával. A szemcsék
anyaga és a szemcsék közötti víz sûrûsége
0,2067 volt 20 oC-on; a mérések erre a hõmérsékletre
vonatkoznak. 13000 szemcsét számoltunk meg különbözõ
magasságokban (közvetlen megfigyeléssel egy tû
fokán át), és igazoltuk, hogy az eloszlás exponenciális;
minden 30 m-os magasságcsökkenés
körülbelül a felére csökkentette a koncentrációt
(a pontos ábrák a 22. pontban szerepelnek). Ezekbõl
a mérésekbõl 70,5·1022 adódott.
 |
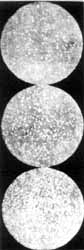 |
| 5. ábra |
5.a ábra |
| A 22. pontban szereplõ ábrák |
Gumiguttiszemcsék egyensúlyi eloszlása (átmérõ
0,6 m, 4 szint felvéve 10 m-onként;
5. ábra),
egy mézgaemulzió egyensúlyi eloszlása
(átmérõ 1 m, 3 szint felvéve
12 m-onként; 5.a ábra)
Jegyzetek
[1] Erklärung des atomischen Wessens des flüssigen
Körperzustandes und Bestätigung desselben durch die sogennanten
Molekularbewegungen (Pogg. Ann. 1863, cxviii. 79).
[2] A bibliográfia abban a cikkben található,
amely a Revue des Questions scientifiques 1909. januári számában
jelent meg; itt Thirion úr igen helyénvalóan felhívja
a figyelmet azoknak a tudósoknak az elképzeléseire,
akikkel együttmûködött.
[3] Journal de Physique, 1888, 2nd Series,
vii. 561; Comptes rendus, 1889, cix. 102; Revue générale
des Sciences, 1895, 1.
[4] Az elv általános jelentõségére
való tekintettel utalnom kell arra az igen érdekes fejtegetésre,
amely ifjabb J. H. Rosny Pluralism címû könyvében
olvasható, 85–9. o. (F. Alcan, 1909)
[5] Ezt az egyenletet elsõ kísérleteim
során állítottam fel (Comptes rendus,
1908. május). Azóta tudomásomra jutott, Einstein és
Smoluchowski, egymástól függetlenül, gyönyörû
elméleti kutatása során, amelyrõl késõbb
még beszélek, már látta, hogy az exponenciális
eloszlás az energia ekvipartíciójának szükséges
következménye. Ezen túlmenõen, úgy látszik,
nem gondoltak arra, hogy ebben az értelemben experimentum crucishoz
juthatunk, amely a Brown-mozgás molekuláris elméle
mellett vagy ellen dönt.
[6] Ezeket a követelményeket jól
kielégítik azok a vértestek számlálására
szolgáló cellák (Zeiss), amelyeket használtam.
[7] Jean Perrin, Comptes rendus, 1908, cxlvi. 167
és cxlvii. 530.
[8] A molekulák gömb alakja és
az átlagos szabad úthosszhoz vezetõ okfejtés
különbözõ egyszerûsítései miatt
lehetetlen pontosan megadni, hogy milyen bizonytalanság rejlik a
viszkozitás, az átlagos szabad úthossz és a
molekulaátmérõ közötti közelítõ
összefüggés numerikus együtthatóiban.
* [A szemcsék sugara a.]
| Vissza |
http://www.kfki.hu/chemonet/ |
 1.
A jelenség elsõ megfigyelése – Amikor egy
egyensúlyban lévõ fluid tömeget, például
egy pohár vizet tekintünk, a tömeg minden része
teljesen mozdulatlannak tûnik számunkra. Ha egy nagyobbb sûrûségû
tárgyat helyezünk bele, a tárgy esik benne, és
ha gömb alakú, pontosan függõlegesen esik. Igaz,
hogy az esés annál lassabb, minél kisebb a tárgy,
de amennyire látható, a tárgy esik, és ez mindig
azzal ér véget, hogy eléri az edény alját.
Ha az edény alján van, mint jól ismert, nem emelkedik
fel újra, s ez az egyik módja annak, hogy Carnot elve (a
másodfajú perpetuum mobile lehetetlensége) megnyilvánuljon.
1.
A jelenség elsõ megfigyelése – Amikor egy
egyensúlyban lévõ fluid tömeget, például
egy pohár vizet tekintünk, a tömeg minden része
teljesen mozdulatlannak tûnik számunkra. Ha egy nagyobbb sûrûségû
tárgyat helyezünk bele, a tárgy esik benne, és
ha gömb alakú, pontosan függõlegesen esik. Igaz,
hogy az esés annál lassabb, minél kisebb a tárgy,
de amennyire látható, a tárgy esik, és ez mindig
azzal ér véget, hogy eléri az edény alját.
Ha az edény alján van, mint jól ismert, nem emelkedik
fel újra, s ez az egyik módja annak, hogy Carnot elve (a
másodfajú perpetuum mobile lehetetlensége) megnyilvánuljon.


