John Dalton
(1766-1844)
A kémia új rendszere
(Részletek)
(1808)
[Második fejezet: William Cecil Dampier-Whetham & Margaret
Dampier-Whetham, eds., Cambridge Readings in the Literature of Science
(Cambridge, UK: Cambridge, 1924); Harmadik fejezet: David M. Knight, ed.,
Classical
Scientific Papers: Chemistry (New York: American Elsevier, 1968)]
(A részletek forrása: Carmen Giunta tudománytörténeti
gyûjteménye)
II. FEJEZET
A TESTEK FELÉPÍTÉSÉRÕL
 A testeknek
három fajtája vagy három állapota különböztethetõ
meg, amelyek különösen magukra vonták az elmélkedõ
kémikusok figyelmét, nevezetesen azok, amelyek rugalmas fluidumoknak,
folyadékoknak és szilárd testeknek neveztetnek. Igen
híres példát mutat be nekünk a víz, egy
test, amely bizonyos körülmények között képes
bármely három állapotot felvenni. A gõzben
felismerhetjük a tökéletes rugalmas fluidumot, a vízben
a tökéletes folyadékot és a jégben a teljesen
szilárd testet. Ezek a megfigyelések hallgatólagosan
elvezettek ahhoz a láthatóan egyetemesen elfogadott nézethez,
mely szerint minden érzékelhetõ kiterjedésû
test, legyen az folyékony avagy szilárd, hallatlan számú
végletesen parányi anyagi részecskébõl
vagy atomból áll, melyeket vonzás tart össze,
a körülményektõl függõen erõsebben
vagy gyengébben. ...
A testeknek
három fajtája vagy három állapota különböztethetõ
meg, amelyek különösen magukra vonták az elmélkedõ
kémikusok figyelmét, nevezetesen azok, amelyek rugalmas fluidumoknak,
folyadékoknak és szilárd testeknek neveztetnek. Igen
híres példát mutat be nekünk a víz, egy
test, amely bizonyos körülmények között képes
bármely három állapotot felvenni. A gõzben
felismerhetjük a tökéletes rugalmas fluidumot, a vízben
a tökéletes folyadékot és a jégben a teljesen
szilárd testet. Ezek a megfigyelések hallgatólagosan
elvezettek ahhoz a láthatóan egyetemesen elfogadott nézethez,
mely szerint minden érzékelhetõ kiterjedésû
test, legyen az folyékony avagy szilárd, hallatlan számú
végletesen parányi anyagi részecskébõl
vagy atomból áll, melyeket vonzás tart össze,
a körülményektõl függõen erõsebben
vagy gyengébben. ...
Hogy egy testnek, mint a víznek, ezen végsõ részecskéi
hasonlítanak-e egymásra, azaz egyforma-e az alakjuk, a súlyuk
stb., meglehetõsen fontos kérdés. Abból, amit
ma tudunk, nincs okunk a részecskéket eltérõknek
tartani. Ha a vízben léteznek részecskék, létezniük
kell a vizet alkotó elemekben is, nevezetesen a hidrogénben
és az oxigénben. Mármost nehezen lehet elképzelni,
hogyan lenne eltérõ részecskék halmaza mégis
egyforma. Ha a víz egyes részecskéi nehezebbek lennének
a másiknál, és ha egy folyadékadag valamely
okból csak ezekbõl a nehezebbekbõl épülne
fel, fel kellene tennünk, hogy ez meglátszana a test fajsúlyán,
amit nem tapasztalhatni. Hasonló figyelhetõ meg más
anyagoknál is. Arra következtethetünk ezért, hogy
minden egynemû test végsõ részecskéi
súlyukban, alakjukban stb. tökéletesen megegyeznek.
Más szóval a víz minden részecskéje
hasonlít a víz más részecskéihez, a
hidrogén minden részecskéje hasonlít a hidrogén
többi részecskéjéhez, és így tovább.
III. FEJEZET
A KÉMIAI SZINTÉZISRÕL
Ha egy test rugalmas állapotban létezik, végsõ
részecskéi nagyobb távolságban vannak egymástól,
mint bármely más állapotban. Minden részecske
egy viszonylag nagy gömb középpontjában helyezkedik
el, és méltóságát azzal õrzi,
hogy a többieket, akik súlyuknál fogva vagy más
okból rátelepednének, tisztes távolságban
tartja. Ha megpróbáljuk egy légkörben a részecskék
számát megbecsülni, kísérletünk ahhoz
hasonlít, mintha a világegyetem csillagait akarnánk
meghatározni. Zavaros gondolat. Ha azonban korlátozzuk a
vizsgálat tárgyát oly módon, hogy egy gáznak
adott térfogatát vesszük szemügyre, meg lehetünk
gyõzõdve arról, hogy akármeddig folytattuk
is a felosztást, a részecskék számának
végesnek kell lennie csakúgy, mint az univerzum egy adott
részében, ahol a csillagok és bolygók száma
nem lehet végtelen.
A kémiai analízis és szintézis nem más,
mint részecskék egymástól való elválasztása
és azok egyesítése. A kémiai lehetõségek
határán belül anyag nem teremtõdik, és
nem pusztul el. Egy hidrogénrészecskét teremteni vagy
elpusztítani olyan próbálkozás, mintha egy
új bolygót kívánnánk bevinni a naprendszerbe,
vagy megsemmisíteni egy már létezõt. Amit megtehetünk,
az pusztán annyi, hogy elválasztunk részecskéket,
amelyeket a kohézió vagy a kombináció egyben
tartott, és egyesítünk olyanokat, amelyek elõzõleg
távol voltak egymástól.
Bármely kémiai vizsgálatban fontos feladat, hogy
megállapítsuk azon egyszerû testek súlyarányát,
amelyek egy összetett testet alkotnak. Sajnos a vizsgálat itt
véget is ért; pedig a test relatív súlyából
következtetni lehetne a testek végsõ részecskéinek
vagy atomjainak súlyarányára, amibõl következne
számuk és súlyuk számos más vegyületben,
ami segítene és irányítana a jövõ
kutatásokban és pontossá tenné azok eredményeit.
Nos, ennek a munkának az egyik nagy célja bemutatni, hogy
mennyire fontos és elõnyös megállapítani
a végsõ részecskék súlyarányát,
mind egyszerû, mind összetett testekben, megállapítani
az összetett részecskét felépítõ
egyszerû elemi részecskék számát és
megtudni azon kevésbé összetett részecskék
számát, amelyek bonyolultabb összetett részecskéket
építenek fel.
Ha van két test, A és B, melyeket kombinálnunk
kell, a lehetséges kombinációk a következõ
módon történhetnek meg, kezdve a legegyszerûbbel,
nevezetesen:
-
1 atom A + 1 atom B = 1 atom C, kettõs
-
1 atom A + 2 atom B = 1 atom D, hármas
-
2 atom A + 1 atom B = 1 atom E, hármas
-
1 atom A + 3 atom B = 1 atom F, négyes
-
3 atom A + 1 atom B = 1 atom G, négyes
-
stb..
A kémiai szintézis vizsgálatára vonatkozóan
a következõ általános szabályok szolgálhatnak
vezérfonalként.
-
1. Ha két test között csak egy kombináció
lehetséges, azt kettõsnek kell tartani, hacsak az ellenkezõjére
nincsen okunk.
-
2. Ha két kombináció figyelhetõ meg, akkor
azokat kettõsnek és hármasnak kell tartani.
-
3. Ha három kombináció figyelhetõ meg, akkor
az egyiket kettõsnek, a másik kettõt hármasnak
kell tekintenünk.
-
4. Ha négy kombináció figyelhetõ meg, akkor
számítsunk egy kettõsre, két hármasra
és egy négyesre stb.
-
5. Egy kettõs vegyületnek mindig nagyobb fajsúlyúnak
kell lennie, mint a két alkotó puszta keverékének.
-
6. Egy hármas vegyület legyen nagyobb fajsúlyú,
mint az õt felépítõ kettõs és
egyszerû test keveréke stb.
-
7. A fenti szabályok és megfigyelések akkor is érvényesek,
ha két olyan test, mint C és D, D és E stb. kombinálódnak.
Ezeket a szabályokat alkalmazva a már jól ismert kémiai
esetekre, a következõ eredményekre jutunk.
1. A
víz hidrogénnek és oxigénnek kettõs
vegyülete és a két elemi atom súlyaránya
közelítõleg 1:7. 2. Az ammónia hidrogén
és nitrogén kettõs vegyülete és a két
atom súlyaránya közelítõleg 1:5. 3.
A nitrózus gáz [nitorgén-monoxid] nitrogénnek
és oxigénnek kettõs vegyülete, ahol az atomok
relatív súlyai 5, ill. 7. A salétromsav [nitrogén-dioxid]
kettõs vagy hármas vegyület attól függõen,
hogyan készül, és egy atom nitrogénbõl
és két atom oxigénbõl áll, 19 összsúlyban.
A nitrózus oxid [dinitrogén-oxid] hasonló a salétromsavhoz
és egy atom oxigénbõl és két atom nitrogénbõl
áll, 17 súlyban. A nitrózus sav a salétromsav
és a nitrózus gáz 31 súlyú kettõs
vegyülete. Az oxi-salétromsav salétromsavnak és
oxigénnek 26 súlyú kettõs vegyülete. 4.
A szénoxid [szén-monoxid] kettõs vegyület egy
atom csontszénbõl és egy oxigénbõl közelítõleg
12 összsúlyban. A szénsav [szén-dioxid] hármas
(néha kettõs) vegyület, egy atom csontszénbõl
és két oxigénbõl 19 súlyban stb. Minden
esetben a súlyok hidrogénatomokban vannak megadva, ami egységnek
tekintetik.
A továbbiakban részletezzük azokat az eseteket és
kísérleteket, amelyekbõl ezeket a következtetéseket
levontuk csakúgy, mint más igen változatos eseteket,
amelyekbõl a fõ savak, a lúgok, a földek, a fémek,
a fémoxidok, a szulfidok, egy sor semleges só végsõ
részecskéinek szerkezetére és súlyára
következtetünk, lényegében minden olyan vegyületére,
amelyet eddig tûrhetõen jól elemeztek. Számos
konklúziót eredeti kísérletek támasztanak
alá.
Az ebben a fejezetben javasolt gondolatok újdonsága és
fontossága miatt hasznosnak tartjuk, hogy ábrákat
mutassunk be, amelyeken néhány egyszerû esetre látszik
a kombinálódás módja. ... Az olyan testek elemeit
vagy atomjait, melyeket itt egyszerûnek tekintünk, kis körrel
és valamilyen megkülönböztetõ jellel ábrázoljuk;
ezekbõl két vagy több egymás mellé helyezve
alkotja a kombinációkat; ha három, vagy több
elasztikus fluidumrészecske kombinálódik eggyé,
feltételezzük, hogy az azonos fajtájú részecskék
taszítják egymást és emiatt foglalják
el megfelelõ helyüket.
Szepesváry Pálné fordítása
| Magyarázat az ábrához |
| 1. |
Hidrogén, relatív súlya |
1 |
| 2. |
Nitrogén |
5 |
| 3. |
Szén |
5 |
| 4. |
Oxigén |
7 |
| 5. |
Foszfor |
9 |
| 6. |
Kén |
13 |
| 7. |
Magnézium |
20 |
| 8. |
Mész [kalcium-oxid (?)] |
23 |
| 9. |
Szóda [nátrium-karbonát (?)] |
28 |
| 10. |
Hamuzsír [kálium-oxid (?)] |
42 |
| 11. |
Stroncitföld [stroncium-oxid (?)] |
46 |
| 12. |
Baritföld [bárium-oxid (?)] |
68 |
| 13. |
Vas |
38 |
| 14. |
Cink |
56 |
| 15. |
Réz |
56 |
| 16. |
Ólom |
95 |
| 17. |
Ezüst |
100 |
| 18. |
Platina |
100 |
| 19. |
Arany |
140 |
| 20. |
Higany |
167 |
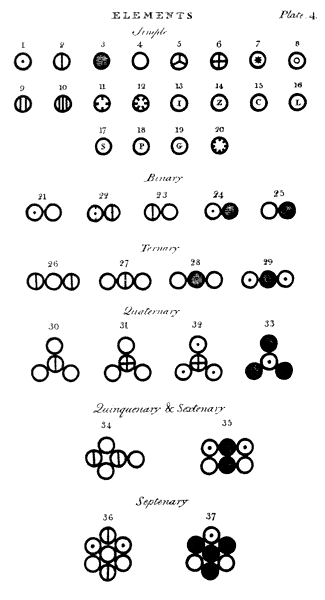
| 21. |
Egy atom víz vagy gõz, egy atom oxigénbõl
és egy atom hidrogénbõl, erõs affinitással
fizikailag összetartva, feltehetõen közös hõburokban;
relatív súlya: |
8 |
| 22. |
Egy atom ammónia, egy nitrogénbõl és egy
hidrogénbõl |
6 |
| 23. |
Egy atom nitrózus gáz [NO], egy nitrogénbõl
és egy oxigénbõl |
12 |
| 24. |
Egy atom szénhidrogen gáz [etén], egy szénbõl
és egy hidrogénbõl |
6 |
| 25. |
Egy atom szénoxid [CO], egy szénbõl és
egy oxigénbõl |
12 |
| 26. |
Egy atom nitrózus oxid [N2O], 2 nitrogén +
1 oxigén |
17 |
| 27. |
Egy atom salétromsav [NO2], 1 nitrogén + 2
oxigén |
19 |
| 28. |
Egy atom szénsav [CO2], 1 szén + 2 oxigén |
19 |
| 29. |
Egy atom bányagáz [metán], 1 szén + 2 hidrogén |
7 |
| 30. |
Egy atom oxisalétromsav [NO3], 1 nitrogén
+ 3 oxigén |
26 |
| 31. |
Egy atom kénsav [SO3], 1 kén + 3 oxigén |
34 |
| 32. |
Egy atom kénhidrogén, 1 kén + 3 hidrogén |
16 |
| 33. |
Egy atom alkohol, 3 szén + 1 hidrogén |
16 |
| 34. |
Egy atom nitrózus sav [NO2 + NO], 1 salétromsav
[NO2] + 1 nitrózus gáz [NO] |
31 |
| 35. |
Egy atom ecetsav, 2 szén + 2 víz |
26 |
| 36. |
Egy atom ammónium-nitrát, 1 salétromsav [NO2]
+ 1 ammónia +1 víz |
33 |
| 37. |
Egy atom cukor, 1 alkohol + 1 szénsav [CO2] |
35 |
| Vissza |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |
 A testeknek
három fajtája vagy három állapota különböztethetõ
meg, amelyek különösen magukra vonták az elmélkedõ
kémikusok figyelmét, nevezetesen azok, amelyek rugalmas fluidumoknak,
folyadékoknak és szilárd testeknek neveztetnek. Igen
híres példát mutat be nekünk a víz, egy
test, amely bizonyos körülmények között képes
bármely három állapotot felvenni. A gõzben
felismerhetjük a tökéletes rugalmas fluidumot, a vízben
a tökéletes folyadékot és a jégben a teljesen
szilárd testet. Ezek a megfigyelések hallgatólagosan
elvezettek ahhoz a láthatóan egyetemesen elfogadott nézethez,
mely szerint minden érzékelhetõ kiterjedésû
test, legyen az folyékony avagy szilárd, hallatlan számú
végletesen parányi anyagi részecskébõl
vagy atomból áll, melyeket vonzás tart össze,
a körülményektõl függõen erõsebben
vagy gyengébben. ...
A testeknek
három fajtája vagy három állapota különböztethetõ
meg, amelyek különösen magukra vonták az elmélkedõ
kémikusok figyelmét, nevezetesen azok, amelyek rugalmas fluidumoknak,
folyadékoknak és szilárd testeknek neveztetnek. Igen
híres példát mutat be nekünk a víz, egy
test, amely bizonyos körülmények között képes
bármely három állapotot felvenni. A gõzben
felismerhetjük a tökéletes rugalmas fluidumot, a vízben
a tökéletes folyadékot és a jégben a teljesen
szilárd testet. Ezek a megfigyelések hallgatólagosan
elvezettek ahhoz a láthatóan egyetemesen elfogadott nézethez,
mely szerint minden érzékelhetõ kiterjedésû
test, legyen az folyékony avagy szilárd, hallatlan számú
végletesen parányi anyagi részecskébõl
vagy atomból áll, melyeket vonzás tart össze,
a körülményektõl függõen erõsebben
vagy gyengébben. ...
