
Henry Eyring és Ronald Norrish
LISZI JÁNOS
A fizikai kémia történetéből
Első rész
1887-et tekinthetjük a fizikai kémia születési évének. Ekkor jelent meg először az Ostwald és van’t Hoff által alapított
Zeitschrift für physikalische Chemie, a máig is létező folyóirat. A “physica” a görög füzisz szóból származik, jelentése: természet. Kezdetben magában foglalta többek között a kémiát is. A kémia valószínűleg az arab al-kimija szóból ered, ami viszont a görög khumeiából származhat. A khumeia jelentése magyarul: (fémet, folyadékot) összeönteni, ötvözni.* Fizikai kémiának tekinthető a kémiának az a része, amely fizikai módszereket használ. A fizika és a kémia között nincs éles határvonal, amit az is jelez, hogy kémiai Nobel-díjat kapott például Rutherford és Herzberg, akik fizikusnak gondolták magukat. Az amerikai vegyész, G. N. Lewis szerint a fizikai kémia az, amit a fizikokémikusok csinálnak. Ugyancsak ő mondta, hogy “minden fizikai kémia, ami érdekes”. A fizikai kémia több nagy tudományterületet ölel fel, így a kémiai termodinamikát, a reakciókinetikát, az elektrokémiát és a felületi jelenségeket, de foglalkozik a fázisok tulajdonságaival, az anyag szerkezetével és a transzportfolyamatok sebességével is. Ha nem is definiálható jól a fizikai kémia, létezik. Ezt az is mutatja, hogy számos egyetemnek van fizikai kémia tanszéke.
 Henry Eyring és Ronald Norrish |
Kik foglalkoznak fizikai kémiával? A legkülönfélébb emberek. Ezt két kiváló reakciókinetikus, Henry Eyring és Ronald Norrish példájával mutatjuk be. K. J. Laidler mindkettőt ismerte személyesen is, az összehasonlítás tőle származik. Eyring mélyen vallásos, aktív mormon volt, aki egy időben a Vasárnapi Iskola felügyelői tisztét is betöltötte. Norrish nem volt hívő, vagy legalábbis nem mutatta. Eyring “professzoros kinézésű”,
barátságos, közvetlen ember volt. Kutatásai során tele volt ötletekkel, gondolatait szívesen megosztotta mindenkivel, még hallgatóival is. Norrish robusztus testalkatú volt, rövidre nyírott bajusszal. Mindig fekete ruhában járt. Nem professzornak, inkább üzletembernek gondolhatták. Zárkózott volt, gondolataira féltékeny – attól tartott, hogy ellopják azokat. Eyring kiváló matematikus volt, elméletben jól felkészült kutató, akitől távol állt a kísérleti munka. Norrish nem volt jó matematikus, elméleti felkészültsége is gyengének mondható. A kísérleti munkában viszont remekelt.Mindketten rossz előadók voltak. Eyring nem készítette elő előadásait, csapongott, hallgatói nem tudták követni. Norrish felkészült az előadásokra, bár hallgatói kételkedtek abban, hogy valóban érti a termodinamikát. Norrish Nobel-díjat kapott, Eyring – sokak meglepetésére – nem. Ez a rövid összehasonlítás és a későbbiekben előadandó történetek azt mutatják, hogy azok is emberek, akik fizikai kémiával foglalkoznak.
A “termo-dinamika” kifejezést William Thomson, a későbbi lord Kelvin használta először egy 1849-ben megjelent közleményében. Magyarul hőtannak mondhatjuk. A klasszikus termodinamika az egyes energiafajták kölcsönös átalakulásaival, az anyag makroszkópos sajátságaival, a fizikai és kémiai egyensúlyok feltételeivel foglalkozik. Az idő nem szerepel a klasszikus termodinamika fogalmai között, ezért helyesebb lenne “termosztatikának” nevezni. A termodinamikában központi szerepet játszanak a következő fo
galmak: hőmérséklet, belső energia, munka, hő és entrópia. A termodinamikai összefüggések az ún. termodinamikai rendszerekre vonatkoznak. Rendszernek tekintjük a világnak azt a részét, amelynek tulajdonságait vizsgáljuk. A rendszert falak határolják. Ha a falak olyan tulajdonságúak, hogy nem engednek meg kapcsolatot a rendszer és környezete között, akkor izolált (=elszigetelt) rendszerről beszélünk. A rendszer állapotát (termodinamikai) tulajdonságokkal jellemezzük. A tulajdonságok változását egyértelműen meghatározza a rendszer kezdeti és végső állapota. A változás független tehát attól az úttól, amelyen történik. Tulajdonság például a térfogat. Képzeljünk el egy tangóharmonikát! Összenyomott állapotban V1 térfogatú, teljesen kihúzott állapotban V2 térfogatú. A térfogat változása: ΔV=V2–V1 . Ez a változás ugyanakkora, ha az összenyomott állapotból közvetlenül juttatjuk a harmonikát a kihúzott állapotba, vagy ha az összenyomott állapotból kiindulva eljátsszuk a Rákóczi-indulót és megállunk a kihúzott állapotnál. A felsorolt mennyiségek közül a térfogaton kívül tulajdonság még a hőmérséklet, a belső energia és az entrópia, de nem tulajdonság a munka és a hő. A tulajdonságok egy része függ a rendszer tömegétől olyan értelemben, hogy kétszer, háromszor nagyobb tömegű rendszerhez a tulajdonságnak kétszer, háromszor nagyobb értéke tartozik. Az ilyen tulajdonságokat extenzív tulajdonságoknak nevezzük. Extenzív tulajdonság például a térfogat. Egy kilogramm víz térfogata egy liter, két kilogrammé két liter. A tulajdonságok másik csoportja független a rendszer tömegétől. Ezek az intenzív tulajdonságok. Intenzív tulajdonság például a hőmérséklet. Egy pohár víznek és a Balatonnak is lehet 25 °C a hőmérséklete.A XIX. század első felében a technika megelőzte a tudományt. James Watt gőzgépe már működött, Stephenson gőzmozdonya már robogott és a tudósok még nem tudták, hogy mi a hő. Pedig egyértelműen hőerőgépekről volt szó. A hő természetét csak a XIX. század végén értették meg (világosan). A tudomány története is azt mutatja, hogy volt valami nehézség a hővel kapcsolatban. Fajsúlyt elsőként Arkhimedész (Kr. e. 287–212) mért Siracusában, amikor megállapította, hogy Hierón király aranykoronájába ezüstöt is tett az ötvös. Fajhőt viszont csak 2000 évvel később mértek. Mi volt ennek a meglepő késedelemnek az oka? Szerintem három dolog:
1. Nem definiálták a termodinamikai rendszert, ezért nem tudtak fegyelmezetten gondolkodni. Például a nagy magyar fizikus, Jedlik Ányos a XIX. század közepén keletkezett, hőről szóló kéziratában egyaránt ír a vulkánokról és a Papin-féle üstről (a kuktafazék őséről). A méretbeli különbségek
szembetűnőek.
2. Nem tettek világos megkülönböztetést a hő és a hőmérséklet között.
3. Nem tudták, hogy a hő (akárcsak a munka) nem termodinamikai tulajdonság.

Greenockban született, Skóciában. 1757 és 1766 között a Glasgow-i Egyetem műszerésze volt. 1765-ben külön sűrítőt tervezett Newcomen gőzgépéhez. 1766-tól 1774-ig mérnökként dolgozott Glasgow-ban, majd Birminghamben. Matthew Boultonnal (1728-1809) új gőzgépet tervezett. Olyan mértékben járult hozzá a gőzgép tökéletesítéséhez, hogy a közvélemény ma őt tartja a gőzgép feltalálójának. Jelentős eredményei voltak a kémiában és a fizikában is. Ő állapította meg, hogy a víz vegyület.
George Stephenson (1781-1848)

Wilamban, Newcastle mellett született. Már gépészinas korában kitűnt ügyességével. 1814-ben építette meg az első használható gőzmozdonyt. Humphry Davy-vel részt vett a biztonsági lámpa feltalálásában. Vezetésével készült el 1825-ben az első általános forgalomra szánt vasút Stockton és Darlington között. A Tyne nagy vasúti hídján, Newcastle-ban szobrot állítottak neki, és róla nevezték el a hidat.
A következőkben néhány termodinamikai tulajdonságot veszünk szemügyre. A hőmérséklettel kezdjük. A köznapi hőmérséklet-fogalom hőérzetünkön alapul. Sorba tudunk rakni tárgyakat (jég, egy pohár víz, forró vasaló stb.) úgy, hogy – mondjuk – balról jobbra haladva egyre melegebbnek érezzük azokat. Ha az így sorba állított tárgyakhoz balról jobbra növekvő számokat rendelünk, akkor ezeket a számokat nevezhetjük a tárgyak hőmérsékletének. Jobb hőmérsékleti skálához juthatunk például, ha egy folyadék térfogatát mérjük állandó nyomáson. Reprodukálható állapotokkal (olvadáspont, forráspont) rögzíthetjük a hőmérsékletskálát, ahogyan például a Celsius-skála esetében tesszük.
Egy rendszer energiája összetevődik a benne levő anyag zéruspont-energiáiból (magenergiák, elektron- és esetleg rezgési zéruspont-energiák), a részecskék termikus energiáiból [transzlációs (=haladó mozgási), forgási, rezgési és elektrongerjesztési energia] és a részecskék közötti kölcsönhatási energiákból. Ezeket a termodinamikai rendszerben levő energiafajtákat – a rendszer környezetének energiájától való megkülönböztetés végett – belső energiának nevezzük és U betűvel jelöljük. A belső energia additív (extenzív) tulajdonság. Egy összetett rendszer belső energiája az alrendszerek belső energiáinak összege.
Watt gőzgépmodelljének metszete |
Stephenson 1825-ben elkészült mozdonya 
|
Emlékezzünk a munkáról tanultakra! A mechanikában az F(x) erő által
Δx úton végzett munka: w=F(x)Δx. A mechanikai munka két tényező szorzata: egy intenzív tényezőé (ez az erő) és egy extenzív tényezőé (ez az elmozdulás). Az egyéb munkaféleségek is hasonló formában adhatók meg. Például, ha az intenzív tényező a nyomás (p), az extenzív tényező a térfogat (V), akkor térfogati munkáról van szó és
wt=-pΔV. Ha az intenzív tényező a kémiai potenciál (μ)**, az extenzív tényező az anyagmennyiség (n), akkor kémiai munkáról beszélünk: wk =
μΔn.
1. ábra. A hengerbe zárt gáz munkát végez
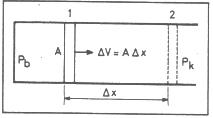 A térfogati munkát kissé részletesebben is megvizsgáljuk. Képzeljünk el egy dugattyúval ellátott hengert (1. ábra). A dugattyú felületének nagysága A. A hengerbe pb nyomású gázt zárunk be. A külső nyomás pk. Ha pb>pk, akkor a dugattyú az 1 helyzetből a 2 helyzetbe jut, a bezárt gáz munkát végez környezetén. A dugattyú akkor áll meg, ha pb=pk, eközben Δx távolsággal mozdul el. A bezárt gáz térfogatnövekedése: ΔV=AΔx. A nyomás és a felület szorzata erő: F(x)=pbA, amivel a munka
wt=-pk. AΔx=–pΔV. A térfogatváltozás megjelenik a munka kifejezésében, innen származik a térfogati munka elnevezés. A negatív előjel azt jelzi, hogy a rendszer végzett munkát környezetén. Ha a nyomást ábrázoljuk a térfogat függvényében, akkor az
ún. P–V-diagramban a görbe alatti terület mutatja a munkát (2. ábra).
A térfogati munkát kissé részletesebben is megvizsgáljuk. Képzeljünk el egy dugattyúval ellátott hengert (1. ábra). A dugattyú felületének nagysága A. A hengerbe pb nyomású gázt zárunk be. A külső nyomás pk. Ha pb>pk, akkor a dugattyú az 1 helyzetből a 2 helyzetbe jut, a bezárt gáz munkát végez környezetén. A dugattyú akkor áll meg, ha pb=pk, eközben Δx távolsággal mozdul el. A bezárt gáz térfogatnövekedése: ΔV=AΔx. A nyomás és a felület szorzata erő: F(x)=pbA, amivel a munka
wt=-pk. AΔx=–pΔV. A térfogatváltozás megjelenik a munka kifejezésében, innen származik a térfogati munka elnevezés. A negatív előjel azt jelzi, hogy a rendszer végzett munkát környezetén. Ha a nyomást ábrázoljuk a térfogat függvényében, akkor az
ún. P–V-diagramban a görbe alatti terület mutatja a munkát (2. ábra).
2. ábra. Nyomástérfogat-diagram
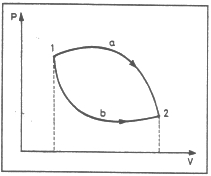 Az 1 kiindulási állapotból számos úton eljuthatunk a 2 végső állapotba, mindegyik úthoz más és más munka tartozik. A lehetséges utak közül kettőt be is jelöltünk. Az a úthoz nyilvánvalóan nagyobb munka tartozik, mint a b úthoz. A munka nagyságát nem határozza meg a kezdeti és a végső állapot, a munka nagysága függ attól az úttól, amelyen végezzük. A munka nem (termodinamikai) tulajdonság, a munka útfüggvény. Mondok egy triviálisabb példát is. Van egy tízemeletes ház. A földszintről föl akarunk vinni az első emeletre egy kosár gyümölcsöt. Ezt megtehetjük úgy, hogy közvetlenül fölmegyünk az első emeletre, de úgy is, hogy először fölmegyünk a tizedikre, majd onnét lemegyünk az elsőre. A második esetben nyilvánvalóan nagyobb munkát végzünk, mint az elsőben.
Az 1 kiindulási állapotból számos úton eljuthatunk a 2 végső állapotba, mindegyik úthoz más és más munka tartozik. A lehetséges utak közül kettőt be is jelöltünk. Az a úthoz nyilvánvalóan nagyobb munka tartozik, mint a b úthoz. A munka nagyságát nem határozza meg a kezdeti és a végső állapot, a munka nagysága függ attól az úttól, amelyen végezzük. A munka nem (termodinamikai) tulajdonság, a munka útfüggvény. Mondok egy triviálisabb példát is. Van egy tízemeletes ház. A földszintről föl akarunk vinni az első emeletre egy kosár gyümölcsöt. Ezt megtehetjük úgy, hogy közvetlenül fölmegyünk az első emeletre, de úgy is, hogy először fölmegyünk a tizedikre, majd onnét lemegyünk az elsőre. A második esetben nyilvánvalóan nagyobb munkát végzünk, mint az elsőben.
A térfogati munkára vonatkozó összefüggésből kifejezzük a térfogatváltozást: ΔV=– wt/p. A térfogat tulajdonság, tehát –wt/p is tulajdonság. A nyomással való osztás egy “nem tulajdonságból” (a munka) tulajdonságot (a térfogat) csinál. Matematikai nyelven ezt úgy mondjuk, hogy 1/p a munka integráló tényezője.
(A következő részben a hőről, a termikus entrópiáról és a termodinamikai hatásfokról lesz szó.)
_________________________
* Egy másik szófejtés szerint a kémia az "al-Kemi" szóra vezethető vissza és "egyiptomi művészet"-et jelent.Természet Világa 2006. január - Termodinamika