|
1. ábra. Egészséges humán agy
FDG-PET-mintázata. 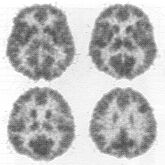
|
2. ábra. Az epileptogén fókusz az FDG-pometabolikus területként
ábrázolódik.
|
Fizikai Szemle honlap |
Tartalomjegyzék |
Fizikai Szemle 2001/5-6. 178.o.
Trón Lajos
Debreceni Egyetem, PET Centrum
A nukleáris medicina képalkotó diagnosztikai módszerei segítségével információt lehet szerezni az élő szervezetben lejátszódó biokémiai folyamatokról. Az eljárások közé tartozó SPECT (Single Photon Emission Computed Tomography) és a pozitronemissziós tomográfia (PET) módszerek alkalmazása során radioaktív izotópokkal jelölt vegyületeket (radiofarmakonok) juttatnak a vizsgálatban részt vevő személybe: Az általában intravénás módon beadott, jelzett molekulák viszonylag rövid idő alatt kialakítanak egy olyan kváziegyensúlyi eloszlást, amelynek jellemzői bizonyos mértékben tükrözik azokat a szöveti történéseket, amelyek az ekvilibrálódás után észlelt, háromdimenziós radiofarmakon-eloszlás kialakításában szerepet játszottak. Ezek a folyamatok sok esetben függenek a vizsgált szervezet aktuális állapotától, ezért ezekkel a non-invazív vizsgálómódszerekkel nyert eredményekből gyakran következtetni lehet a funkcionális állapotra. Az ilyen értelemben vett funkcionális állapot vonatkozhat egészséges egyének élettani állapotára, betegekben kialakuló kóros állapotra vagy speciálisan megtervezett gondolkodási tevékenységet kísérő, agyi anyagcsere-változásokkal járó állapotokra.
A SPECT-módszer instrumentális kelléke egy nagyméretű (40-60 cm átmérőjű) szcintillációs kristály, amelyben nyomjelző radioaktív izotópok bomlását kísérő gammakvantumok felvillanásokat keltenek. A vizsgálati személy és a kristály közé a kristály felületére merőleges tengelyű, párhuzamos furatokat tartalmazó kollimátort helyeznek abból a célból, hogy az egyes szcintillációs események kristályon belüli lokalizációja, valamint a gamma-kvantumokat eredményező radioaktív bomlások helye közötti mutatkozó szférikus korreláció egy része megmaradjon. A kristályon belül a felvillanások helyzetérzékeny detektálását a kristálynak kollimátorral átellenes felületét beborító fotoelektron-sokszorozó rendszerrel (ezek száma típustól függően 40 és 100 között változhat), valamint az ahhoz kapcsolódó elektronikával biztosítják. Rögzített geometria mellett ilyen módon előállítható a radiofarmakon szervezeten belüli háromdimenziós eloszlásnak egy vetületi képe. Ha a méréseket a kristálynak a vizsgálati személy hossztengelye körüli elforgatásával több különböző geometria mellett megismétlik, a különböző irányú vetületi képekből a háromdimenziós radiofarmakon-eloszlás is rekonstruálható.
Kétségtelen, hogy a SPECT-módszernek számos előnyös vonása mellett hátrányai is vannak. Ezek között elsősorban a mechanikus kollimátor alkalmazásával összefüggő, csökkent fényerőt kell említeni. A furatok közötti úgy méretezik a falvastagságot, hogy az biztosítsa a kristályfelszínre nem merőleges irányban haladó gammakvantumok közel 100%-os abszorpcióját. Emiatt a képalkotás számára információt hordozó gamma-kvantumok száma több nagyságrenddel elmarad a szervezetbe bejuttatott össz radioaktivitásból származó gamma-kvantumok száma mögött. Kényelmetlenséget jelent az is, hogy a különböző irányú vetületi képek elkészítése csak egymást követően történhet, ezért a vizsgálatok végrehajtásához viszonylag hosszú időre van szükség.
A SPECT-módszer mindkét hátrányát ki lehet küszöbölni, ha a farmakon-molekulák nyomjelzésére pozitronbomló izotópokat használunk. A szöveti környezetbe ágyazott bomló magokból emittált pozitronok átlagos lineáris hatótávolsága 0,2-2,6 mm közé esik a maximális pozitron-energiák értékétől függő módon. A lefékeződött pozitronok és a szöveti elektronok szétsugárzásából származó két, 511 keV energiájú gamma-kvantum a kölcsönhatás helyét jó közelítéssel egymással ellentétes irányban hagyja el. Az összetartozó gammafotonokat koincidenciában detektáló két kisméretű kristály egy olyan térbeli egyenest jelöl ki, amely áthalad az szétsugárzás helyén. Ez a hely 0,2-2,6 mm pontossággal megegyezik a pozitronbomlás (a nyomjelzett farmakon) helyével. Ez az elektronikus kollimáció, valamint a gamma-kvantumok egyenletes szögeloszlása lehetőséget nyújt arra, hogy a vizsgálati személyben kialakult egyensúlyi radiofarmakon-eloszlásról úgy lehessen vetületi képeket előállítani, hogy a rendelkezésre álló gamma-kvantumok igen nagy hányadát felhasználjuk a képalkotás céljára. Ha a szcintillációs detektorokat gyűrűszerűen helyezzük el a vizsgálati személy körül, az “összes" vetítési irányhoz tartozó vetületi képek egyidejűleg előállíthatók. Egyetlen gyűrű alkalmazásával természetesen csak a (néhány milliméteres) detektorméretek által megszabott vastagságú, korong alakú régió radiofarmakon-eloszlásáról lehet információt nyerni. Az egymás mellé helyezett detektorgyűrűk számának növelésével a radiofarmakon-eloszlás tetszőlegesen növelhető térbeli hányada képezhető le egyidejűleg.
A PET-technika alkalmazásával kapcsolatos további előny, hogy kis energiájú ciklotronok segítségével jó hozammal állíthatók elő az élő szervezetben nagy mennyiségben előforduló elemek rövid felezési idejű, pozitronbomló izotópjai: 15O (T 1/2 = 2 perc), 13N (T 1/2 = 10 perc), 11C (T 1/2 = 20 perc), 18F (T 1/2 = 110 perc). Ezekkel a “biológiai" izotópokkal az élő szervezetekben található molekulák nagyon nagy hányada megjelölhető anélkül, hogy azoknak a biokémiai sajátosságai megváltoznának.
|
1. ábra. Egészséges humán agy
FDG-PET-mintázata. 
|
2. ábra. Az epileptogén fókusz az FDG-pometabolikus területként
ábrázolódik.
|
A PET-vizsgálatok során leggyakrabban alkalmazott radiofarmakon a 18F-fluorodezoxiglukóz (FDG). Ez a glukózanalóg a fiziológiás glukózmolekulákkal azonos mechanizmusok révén jut be a sejtekbe, ahol az intracelluláris hexokináz enzim hatására foszforilálódik. Az FDG-6P reakcióterméket a glikolitikus enzimek már nem fogadják el szubsztrátként, ezért, valamint a foszfátcsoporttal kapcsolatos, poláros karakterek miatt (a lipid membránon nem képes áthaladni) a sejteken belül felhalmozódik. Ugyanakkor a sejtekbe történő felvétel szempontjából meglévő glukózanalógia biztosítja, hogy az intracelhaláris FDG-akkumuláció mértéke szoros korrelációban áll a sejtek glukózfelvételével. Ez a tény magyarázza, hogy a fokozott FDG-akkumuláció mérésével kimutathatók és körülhatárolhatók azok a szöveti régiók, amelyeknek nagy a glukóz-(energia) igénye.
Az 1. ábra egy egészséges önkéntes FDG-vel végzett agyi PET-vizsgálatának eredményét mutatja a hossztengelyre merőleges négy különböző helyzetű metszet mentén. A szürke színskálán a világos tónusok kisebb mértékű, az egyre sötétebb tónusok egyre növekvő mértékű FDG-felhalmozódást jelölnek. A képek jól dokumentálják, hogy a koponya-kontúrhoz közeli agykéreg (szürkeállomány), valamint bizonyos kéreg alatti struktúrák FDG-halmozása jelentősen meghaladja a mélyebben fekvő fehérállomány FDG-felvételét.
3. ábra. Előrehaladott stádiumú mű Rasmussen-szindróma jellegzetes agyi glukóz metabolikus
képe.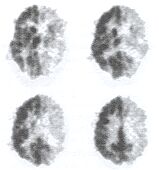
Az egészséges agy FDG-halmozásának az 1. ábrán mutatott jellegzetességei markáns módon megváltoznak több kórfolyamat esetén. A 2. ábra egy epilepsziás beteg FDG-vizsgálatának eredményét demonstrálja. Az epilepsziás kórképek egy részénél a rohamokat nem lehet gyógyszeres kezeléssel kivédeni. A gyógyszerrezisztens esetekben megoldást jelenthet a műtéti beavatkozás, ha a rohamok indításáért egyetlen agyi régió felelős. Az ilyen epileptogén fókusz lokalizálása számos esetben csak Per-vizsgálatok segítségével történhet. A 2. ábrán nyíl mutat arra a hipometabolikus régióra, amelynek megváltozott glukóz-anyagcsere intenzitása jelzi az epileptogén fókuszt.
Számos neurodegeneratív folyamat karakterisztikus agyi anyagcsere-változásokkal jár együtt, ezért az egyes kórképek differenciál diagnosztikájában a PET-vizsgálatok igen hatékony eszközt jelentenek. Különösen nagy jelentősége van az Alzheimer-kór korai diagnosztikájának. A PET-módszer felhasználásával sok olyan esetben diagnózishoz lehet jutni, amely esetekben az egyéb diagnosztikai lehetőségek nem szolgáltatnak elegendő alapot a kórismézéshez: A téves diagnózisok indokolatlan vagy nem megfelelő gyógyszeres terápiához vezethetnek, amelyeknek nagyon komoly káros következményei lehetnek anélkül, hogy egy ilyen kezelés a legkisebb mértékben is hozzájárulna a beteg állapotának javulásához. Hasonlóképpen in adekvált kezelést eredményez, ha a fel nem ismert kórkép miatt a beteg nem a megfelelő kemoterápiás ellátásban részesül. A neurológiai kórképek jellegzetes agyi FDG-mintázatai közül a 3. ábrán bemutatjuk egy előrehaladott stádiumú Rasmussen-szindrómás beteg FDG-agyi vizsgálatát. Az ábrán szembetűnő, hogy az egyik féltekében szinte teljesen megszűnt a glukóz-anyagcsere, ami ennek a hemiszfériumnak a szinte teljes funkcióvesztésére utal.
Az intenzív sejtosztódás általában fokozott glukózigénnyel jár együtt. A 4. ábra FDG-halmozásra utaló, sötét tónusú régiói azt jelzik, hogy ezeknek a szöveti régióknak a környezetnél jelentősen nagyobb a glukózfelvétele. A PET-vizsgálat eredményei a klinikai tünetekkel és egyéb vizsgálati eredményekkel együtt rosszindulatú, agyi daganatos folyamatként értelmezhetők.
|
4. ábra. Az agytumor a környezeténél jobban halmozza az
FDG-t. 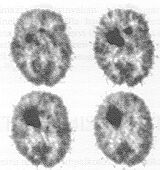
|
5. ábra. A metionin-PET-vizsgálat az FDG-PET-módszernél alkalmasabb az alacsony grádusú tumorok kimutatására. 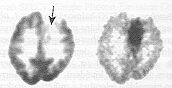
|
A tumoros szövetek glukózigénye nem minden esetben haladja meg a környezet glukózigényét. Vannak olyan rosszindulatú daganatok, amelyek glukóz metabolikus aktivitása megegyezik a környezetével, sőt bizonyos alacsony grádusú vagy alacsony malignitású tumorok csökkent anyagcseréjű régióként is ábrázolódhatnak. Az
5. ábrán berajzolt nyíl egy olyan régióra mutat, amelyen belül a szöveti FDG-halmozás nem éri el a környezetét. A negatív FDG-vizsgálati eredménynek ellentmondtak a klinikai tünetek, ezért nyomjelzett aminosavval (11C-metionin) is vizsgálatot kezdeményeztek a szóbanforgó régióban. A metionin PET-felvétel fokozott fehérjeszintézist mutatott ki, az eredmények alacsony grádusú tumorra utalnak. Közismert, hogy az agyszövet glukózfelhasználása sokszorosan felülmúlja bármely egyéb szövetét. Ez a tény teljes összhangban áll az 1. ábrán bemutatott egészséges agy FDG-halmozó mintázatával, amely jelentős strukturális elemet tartalmaz. Ilyen esetekben az élettani viszonyokkal együttjáró, eleve nagy radiofarmakon-halmozás olyan magas “hátteret" jelent, amely mellett a funkcionális eltéréshez kapcsolódó, esetleg kisebb amplitúdójú jel detektálása csak viszonylag kis érzékenységgel történhet. A metionin-PET-vizsgálat nagyobb érzékenysége az egészséges agy alacsonyszintű fehérjeszintézisével függ össze, hiszen a kismértékű fiziológiás metionin-halmozás kedvezően alacsony hátteret biztosít a kórfolyamatokat kísérő, akár kisebb amplitúdójú jelek észleléséhez is.
A 6. ábra 6. ábra. Egésztest
FDG-PET-vizsgálat.
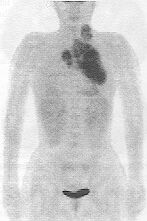
7. ábra. Egészséges és károsodott szívizom FDG-PET-vizsgálata.
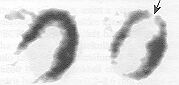
A koronaria szívbetegség kivizsgálásában a PET-módszer igen nagy diagnosztikus pontosságot kínál a szívizom életképességének megítélésére. A 7. ábrán bemutatott képek az egészséges és a károsodott szívizom FDG-felvételének jellegzetességeit mutatják. A nyíllal jelölt régió alacsony FDG-halmozása egyértelműen jelzi, hogy az érintett szöveti tartományban az elégtelen vérellátás miatt erősen csökkent az életképes szívizom mennyisége. Koszorúér-elzáródás, illetve szűkület esetén a szív teljesítőképessége csökken, mert a nem megfelelő vérellátás miatt nem biztosítható az energiaellátás. Az esetek egy részében a myocardium irreverzibilisen károsodik, de vannak olyan kórképek is, amelyekben a funkciókiesés reverzibilis, a hibernált szívizom-szövet olyan módon adaptálódik a krónikusan oxigénhiányos állapothoz, hogy a kontraktibilitásának csökkentésével megőrzi életképességét. Az ezzel együttjáró csökkent energiafelhasználás egyensúlyban marad a gyér szöveti perfúzióval. Ha a 13N-ammónia nyomjelző anyaggal végzett PET-vizsgálatok segítségével a szívizom egy régiójára igazolható a csökkent mértékű vérellátás, ugyanakkor ugyanennek a régiónak az FDG-halmozással mért életképessége is kimutatható. Ez biztos jele annak, hogy a szóbanforgó szöveti régió fiziológiás perfúziós viszonyainak egy koszorúér-protézis beépítésével történő helyreállításával a funkcionális deficit megszüntethető. Ezzel szemben csökkent vérellátás csökkent FDG-felhalmozással jár együtt. Ez annak a jele, hogy a szívizom életképessége jelentős mértékben csökken, ilyenkor a szívműtét elvégzése nem vezet a beteg állapotának javulásához.
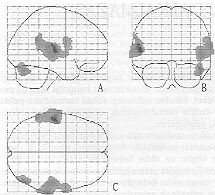
8. ábra. Beszéd-aktivációs agyvizsgálat parametrikus képei.
Az előzőekben már szó esett arról, hogy az érzékeny PET-módszer segítségével egészen kicsiny funkcionális változások is kimutathatók. Gyakran előfordul azonban, hogy ezeket a funkcionális eltéréseket kizárólag a PET-vizsgálatok alapján igen nehéz meghatározott anatómiai struktúrákhoz rendelni, hiszen a mért radiofarmakon-mintázatok alig utalnak a struktúrára. A funkcionális jellegzetességeknek az anatómiai lokalizálása megoldható, ha a PET-képeket és valamilyen anatómiai képalkotó eljárás (computer tomográfia vagy mágneses rezonancia) segítségével nyert képeket azonos koordináta rendszerben azonos helyzetbe transzformáljuk és azokat együttesen jelenítjük meg. A funkcionális információt színkódolt formában, a szerkezettel kapcsolatos információt pedig szürke skálán vizualizálják, így a funkció és a szerkezet jellegzetességei ugyanazon a képen tanulmányozhatók.
Agyműtétek tervezése során különös gondossággal kell eljárni, ha a műtéti terület közel esik valamilyen életfontosságú vagy az életminőséget döntően befolyásoló agyi központhoz. A műtéti tervezést megkönnyíti, ha a műtéttel veszélyeztetett és megóvni kívánt agyi funkciók során aktiválódó agyi struktúrákat azonosítani lehet. Az erre a célra szolgáló agyaktivációs PET-vizsgálatok során olyan apoláros karakterű radiofarmakont szokás alkalmazni, amely az agyi kapillárisok falán (vér-agy-gát) viszonylag könnyen átlép és a szöveti lipid barriereken keresztül jó közelítéssel szabadon diffundál. A 15O-butanol perfúziós nyomjelző rendelkezik ezekkel a sajátosságokkal és injektálását követően 10-15 szekundumon belül kialakul az agyon belül az egyensúlyi eloszlása. Ez igen előnyös a félórás időskálán egyensúlyba jutó FDG alkalmazásával szemben, hiszen a másodperces-egyperces időskálán sokkal könnyebb létrehozni és tiszta formában megőrizni speciális agyi funkcionális állapotokat, mint 30-50 perces időskálán.
Az agyaktivációs vizsgálatok kivitelezése során a legkülönbözőbb ingereket lehet alkalmazni (beszédképzés, beszédértés, memóriában tárolt információ aktiválása, vizuális inger stb.). A 15O-butanol akkumulációs képek jel/ zaj viszonya kedvezőtlen, hiszen 15O izotóp rövid felezési ideje megnehezíti a jó statisztikájú mérési adatokat biztosító, elegendően hosszú idejű adatgyűjtést. Emiatt egy referencia-állapothoz viszonyított, értékelhető eltérés analíziséhez számos butanol-injektálásra és az azt követő adatgyűjtésre van szükség. A mérések kiértékelése képpontonként történik úgy, hogy minden egyes kiválasztott képpont esetén egy statisztikai hipotézis-vizsgálatot végeznek. Ehhez felhasználják a referencia- és kísérleti állapothoz tartozó 10-10 vagy 15-15 butanol-akkumulációs adatot. A képpontonként végrehajtott mintegy félmillió hipotézisvizsgálat eredményét parametrikus képen jelenítik meg olyan módon, hogy minden egyes képponthoz képszerűen feltüntetik a Student-eloszlás “t" paraméterének azon értékét, amely mellett az adott képpontban szignifikáns a stimuláció eredményezte perfúzió-fokozódás. A parametrikus képek áttekinthetősége érdekében a megjelenítéshez egy alkalmas “t"-küszöbértéket választanak, hogy csak a legmarkánsabb módon aktiválódó agyi struktúrák ábrázolódjanak.
A 8. ábrán egy beszédaktivációs vizsgálat parametrikus képeit mutatjuk be. Az aktivált régiók “t" értékei szürke skálán vannak megjelenítve három különböző irányú vetületi képen. Az oldalirányú (A) vetületi képen, illetve a hátulnézeti (B) és felülnézeti (C) képeken a szokásnak megfelelően feltüntettük az agy kontúrvonalát is, hogy az aktivációknak érzékelhető legyen az agyon belüli térbeli elhelyezkedése.
Az agyaktivációs vizsgálatok azon alapulnak, hogy az agyi funkciókban érintett neuronok fokozott működése miatt gyakran depolarizálódnak. A neuronok között akciós potenciálok segítségével történik a kommunikáció, amelyeknek a kialakításában nátrium és kálium ioncsatorna aktivitások játszanak szerepet. Mindkét típusú csatornák rövid időre (milliszekundumos időtartamokig) “kinyitnak" minden egyes depolarizáció, illetve repolarizáció során, és a nyitott állapotok idején folyó ionáramok miatt az intracelluláris ionkoncentrációk kismértékben megváltoznak. Az egyensúlyi ionkoncentrációk helyreállítása energiaigényes, ezért megnő a funkcióban részt vevő, aktivált agyi régiók glukózfelhasználása. A fokozott glukózigény kielégítéséhez a vérellátás fokozódása szükséges, hogy a szükséges glukózmennyiség rendelkezésre álljon. Ez egyúttal azt jelenti, hogy az energiaigény és a vérellátás között szoros csatolás áll fenn, ami lehetővé teszi, hogy az agyaktivációs vizsgálatokat a jó időfelbontású 15O-butanol PET-módszerrel lehessen végezni.
A felsorolt alkalmazások a lehetséges PET-vizsgálatoknak csupán egy részét fedik le. A felsorolt radiofarmakonokon kívül többszáz olyan nyomjelző molekula ismert, amelyek segítségével az élő szervezet különböző funkcionális sajátosságai (zsírsav-anyagcsere, enzimaktivitások, specifikus receptor koncentráció változások stb.) tanulmányozhatók.
Összefoglalásul meg kell jegyezni, hogy a PET-módszernek is megvannak a korlátai, ezek között a viszonylag gyengébb térbeli felbontóképességet (4-6 mm) említem, valamint azt, hogy általában nem szolgáltat struktúrát és információt. Ez egyúttal azt is jelzi, hogy a PET-módszer semmilyen egyéb képalkotó eljárást nem helyettesít. Az élő szervezeteknek és azok működésének mind teljesebb megismeréséhez csak minden rendelkezésre álló eljárás együttes felhasználásával lehet közelebb jutni.