William Prout
(1785-1850)
A testek gázállapotbeli fajsúlya és atomjainak
súlya közötti kapcsolatról
Annals of Philosophy 6, 321-30 (1815) [név
nélkül jelent meg]
(David M. Knight, ed., Classical Scientific Papers--Chemistry, Second
Series, 1970)
 A következô
tanulmány szerzôje a legnagyobb félénkséggel
tárja írását a nyilvánosság elé,
mert bár minden erejével a tudományos igazságra
törkedett, kísérleti emberként nem bízik
annyira képességeiben, hogy másoknak sokkal többet
merjen mondani annál, mintsem majd eldôl, mennyire fontos
az eredménye, és ha valaki hajlandó lesz azt megvizsgálni,
következtetéseit majd alátámasztja vagy elutasítja.
Ha a következtetések hibásnak bizonyulnának,
még mindig napvilágra kerülhetnek új tények
vagy a régiek válhatnak megalapozottabbakká; de ha
sikerülne ôket igazolni, a kémia egész tudománya
kerülne új és érdekes megvilágításba.
A következô
tanulmány szerzôje a legnagyobb félénkséggel
tárja írását a nyilvánosság elé,
mert bár minden erejével a tudományos igazságra
törkedett, kísérleti emberként nem bízik
annyira képességeiben, hogy másoknak sokkal többet
merjen mondani annál, mintsem majd eldôl, mennyire fontos
az eredménye, és ha valaki hajlandó lesz azt megvizsgálni,
következtetéseit majd alátámasztja vagy elutasítja.
Ha a következtetések hibásnak bizonyulnának,
még mindig napvilágra kerülhetnek új tények
vagy a régiek válhatnak megalapozottabbakká; de ha
sikerülne ôket igazolni, a kémia egész tudománya
kerülne új és érdekes megvilágításba.
Talán szükséges elôrebocsájtani, hogy
a feltárandó megfigyelések fôként a térfogatoknak
azon a tételén alapszanak, amelyet elôször Gay-Lussac
úr általánosított, és amelyet – legalábbis
a szerzô tudomása szerint – általánosan elfogadnak
a kémikusok.
Az elemi gázok fajsúlyáról
1. Oxigén és nitrogén. A kémikusok
– úgy tûnik – a levegôt nem tekintik kémiai elvek
szerint képzôdô vegyületnek, vagy legalábbis
csekély hangsúlyt fektetnek erre a körülményre.
Régóta ismert azonban, hogy a levegô négy térfogat
nitrogénbôl és egy térfogat oxigénbôl
áll. Ha az oxigén atomját 10-nek, a nitrogén
atomját 17,5-nek tekintjük, a levegô súly szerint
egy atom oxigénbôl és két atom nitrogénbôl*
áll, [súly szerinti] százalékos
összetétele pedig:
| oxigén |
22,22 |
| nitrogén |
77,77 |
Emiatt valódi kémiai vegyületnek kell tekinteni,
mert valójában csakis ez a feltevés magyarázza,
hogy a légkör levegôje az egész világon
egyöntetû, amit számos kísérlet is igazol.
Ezeknek az adatoknak az alapján az oxigén és a nitrogén
fajsúlya (ha a légkör levegôjét 1,000-nek
tekintjük) [1] :
| oxigén |
1,1111 |
| nitrogén |
0,9722 |
2. Hidrogén. A hidrogén fajsúlyát
– mivel a gáz nagyon könnyû és makacsul megköti
a vizet – minden más gázénál nehezebb meghatározni.
Ezeknek az akadályoknak a hatására lemondtam arról,
hogy pontosabb eredményre jussak, mint ami a szokásos mérési
eljárással kapható. Úgy vélem, hogy
a hidrogén fajsúlyát sokkal pontosabban meg lehet
határozni számítással egy olyan nagyobb sûrûségû
vegyület fajsúlyából, amelyben a hidrogén
aránya ismert. Az ammóniagáz tûnt a legalkalmasabbnak
erre a célra, hiszen Sir H. Davy nagy gonddal határozta
meg a fajsúlyát, és a hiba nagyságát
igen csekélyre csökkentette, hogy fajsúlya a vízgôzéhez
igen közel áll. Ráadásul Biot és
Arrago
eredménye majdnem pontosan megegyezik Sir H. Davyével, ami
0,590164, feltéve, hogy a légköri levegô 1,000.
Az ammónia fajsúlyát 0,5902-nek fogjuk tekinteni,
amire feljogosít, hogy Biot és Arrago kissé nagyobb
értéket állapított meg Sir H. Davynél.
Két térfogat ammónia három térfogat
hidrogénbôl és egy térfogat nitrogénbôl
áll. Tehát a hidrogén fajsúlyára 0,694
adódik [2], ha a légköri levegô
1,000. Megfigyelhetô, hogy az oxigén imént kapott fajsúlya
éppen 16-szorosa a hidrogén most megállapított
fajsúlyának, a nitrogéné pedig pontosan 14-szerese.
[3]
3. Klór. A sósav sûrûsége –
Sir H. Davy kísérletei szerint, amelyek pontosan egyeznek
Biot és Arrago méréseivel – 1,278. Ha feltesszük,
hogy ez a fajsúlyérték ugyanannyira hibás,
mint az elôbb az oxigéné és a nitrogéné
(ami nem szigorúan pontos, de ésszerû feltevés,
hiszen a kísérleteket hasonló módon folytatták),
a gáz fajsúlyára körülbelül 1,2845
adódik; [4] és mivel ez a vegyület
egy térfogat klórból és egy térfogat
hidrogénbôl áll, a klór fajsúlya számítással
2,5-nek adódik. [5] Dr. Thomson azt
állítja, hogy 2,483 megközelíti a valódi
értéket, [6] Gay-Lussac eredménye
pedig majdnem egyezik az övével.[7] Ezért
tejes joggal következtethetünk arra, hogy a klór fajsúlya
nem tér el nagyon 2,5-tôl. Ezzel a feltevéssel a klór
fajsúlya pontosan 36-szorosa a hidrogénének.
Azoknak a gázállapotú elemi anyagoknak a fajsúlyáról,
amelyek közönséges hômérsékleten nem
gázok
1. Jód. Némi okkal feltételezem, hogy Gay-Lussac
úr kitûnô közleményében ezen anyag
egy atomjának súlyát kissé túlbecsülte.
Ennek igazolására 50 granum mészbôl desztillált
jódot 30 granum nagyon tiszta cinklemezkével emésztettem
[1 granum = 64,8 mg]. A keletkezô oldat színtelen és
átlátszó volt; 12,9 granum cink oldódott fel.
Tehát eszerint a kísérlet szerint 100 rész
jód 25,8 rész cinkkel egyesül, és a jódatom
súlya 155,[8] ha a cinkét 40-nek vesszük.
Ezekbôl az adatokból a gázállapotú jód
fajsúlyára számítással 8,611111 adódik,
ami pontosan 124-szerese a hidrogénének.[9]
[Néhány elem – napjainkban használt – relatív
atomtömegének közelítô értéke
megtalálható a cikk után. Szerk.]
2. Szén. Felteszem, hogy a szénatom súlya
7,5. Ezért egy térfogat gázállapotú
szén fajsúlya számítással 0, 4166-nak
adódik, ami pontosan 12-szerese a hidrogénének.
3. Kén. Egy atom kén súlya 20. Eszerint
a kén gázának fajsúlya megegyezik az oxigénével,
vagyis 1,1111, és így pontosan 16-szorosa a hidrogénének.
4. Foszfor. Számos kísérletet végeztem,
hogy megállapítsam ezen anyag atomjának súlyát,
de végül is eredményeimet nem találtam kielégítônek,
és miután pihenésre van szükségem, egyelôre
le kell mondanom a további munkáról. Eredményeim
jól megközelítik Dr. Wollaston adatait, amelyeket
ezért helyesnek – vagy majdnem annak – tekintek. Így a foszforra
17,5, a foszforsav[anhidrid]re 37,5 adódik, [10]
és ezeket a számokat egyelôre elfogadom.
5. Kalcium. Dr. Marcet szerint a szénsavas mész
(kalcium-karbonát) 43,9 rész szénsavból [szén-dioxidból]
és 56,1 rész mészbôl [kalcium-oxidból]
áll.[11] Ezért mivel 43,9 : 56,1 =
27,5 : 35,1 vagy jó közelítéssel 35, 35 – 10
= 25 adódik a kalcium atomjára. Tehát gázának
fajsúlyára 1,3888 adódik, ami pontosan 20-szorosa
a hidrogénének.
6. Nátirum. 100 granum híg sósav 18,6 granum
szénsavas meszet [kalcium-karbonátot] oldott fel. Ugyanennyi
híg sav csak 8,2 granum szénsavas meszet oldott fel, ha elôzôleg
30 granum nagyon tiszta, kristályosított bázikus nátrium-karbonátot
[nátrium-karbonátot] adtam az oldathoz. Ezért 30 granum
kristályosított bázikus nátrium-karbonát
10,4 granum szénsavas mésszel egyenértékû,
és 10,4:30 = 62,5:180. Hô hatására 100 granum
kristályosított bázikus nátrium-karbonát
62,5 granum vizet adott le. Tehát ugyanezen só 180 granuma
112,5 granum – 10 atomnyi – vizet és 67,5 granum száraz bázikus
nátrium-karbonátot tartalmaz. A szóda atomjára
67,5 – 27,5 = 40, a nátriuméra 40 – 10 = 30 adódik.
Ezért gázállapotban egy térfogat súlyára
1,6666 adódik, ami pontosan 24-szerese a hidrogénének.
7. Vas. 100 granum híg sósav – az elôzôhöz
hasonlóan – 18,6 granum szénsavas meszet oldott fel. Ugyanennek
a savnak azonos mennyisége 10,45 granum vasat oldott fel. Mivel
18,6 : 10,45 = 62,5 : 35,1, vagy a korábbihoz hasonlóan,
35, a vas atomjának súlya 35. A gázállapotban
levô fém fajsúlyára 1,9444 adódik, ami
pontosan 28-szorosa a hidrogénének.
8. Cink. Ugyanennek a savnak 100 granuma – az elôzôhöz
hasonlóan – feloldott 18,6 granum szénsavas meszet és
11,85 granum cinket. 18,6 : 11,85 = 62,5 : 39,82, az elôbbihez hasonlóan
tehát a cink atomjának súlya 40. Gázállapotban
a fajsúlyára 2,222 adódik, ami pontosan 32-szerese
a hidrogénének.
9. Kálium. Ugyanennek a savnak 100 granuma – az elôzôhöz
hasonlóan – 18,6 granum szénsavas meszet oldott fel, de 20
granum kálium-szuperkarbonát hozzáadása után
csak 8,7 granum szénsavas meszet. Ezért 20 granum kálium-szuperkarbonát
9,9 granum szénsavas mésszel egyenértékû.
Mivel 9,9 : 20 = 62,5 : 126,26, a kálium-szuperkarbonátra
126,26 adódik. A hamuzsír atomjának súlya 126,26
- (55 + 11,25) = 60, a kálium atomjáé 60 – 10 = 50.
Ezért gázállapotban egy térfogat súlyára
2,7777 adódik, ami pontosan 40-szerese a hidrogénének.
10. Bárium. Ugyanennek a savnak 100 granuma pontosan ugyanannyi
bárium-karbonátot oldott fel, mint szénsavas meszet.
Ezért a bárium-karbonát atomjának súlya
125, és a báriumé 125 – 27,5 = 97,5. Tehát
a bárium gázának fajsúlyára 4,8611 adódik,
ami pontosan 70-szerese a hidrogénének. [A 97,5 valójában
a bárium-oxidra vonatkozik, az 1. táblázat 3. oszlopa
a bárium atomsúlyára már 97,5 – 10 = 87,5-et
ad meg. Szerk.]
Hozzátenném, hogy a fenti kísérletek során
a lehetô legnagyobb figyelmet fordítottam a pontosságra,
és a kísérletek többségét sokszor
– szinte pontosan ugyanazzal az eredménnyel – megismételtem.
A következô táblázatok összegzik a fenti
eredményeket és közlik a térfogatok és
súlyok oxigénre és hidrogénre vonatkoztatott
arányait. Analógiás alapon olyan anyagok súlyát
is feltüntetik, amelyek nem estek szigorú vizsgálat
alá.
1. táblázat. Elemi anyagok
| Név |
Fajsúly (hidrogén
= 1) |
Az atom súlya
(2 térf. hid-
rogén
=1) |
Az atom súlya
(oxigén
= 10) |
Az atom súlya
(oxigén
= 10, kí-
sérletbôl) |
Fajsúly (légköri levegô = 1) |
Fajsúly (légköri levegô = 1, kí-
sérletbôl) |
100 köb-
hüvelyk súlya, granum; (barom. 30, hôm. 60)* |
100 köb-
hüvelyk súlya, granum; (kísérlet-
bôl) |
Megjegyzés |
| hidrogén |
1 |
1 |
1,25 |
1,32 |
0,06944 |
0,073(1) |
2,118 |
2,23 |
(1)Dr.Thomson. L. Annals of Philosophy, I. 177. |
| szén |
6 |
6 |
7,5 |
7,54(2) |
0,4166 |
-- |
12,708 |
-- |
(2)Dr. Wollaston, Biot és Arrago nyomán. Phil.
Trans. CIV. 20. Dr. Thomson szerint 7,51. Annals of Philosophy,
II. 42. |
| nitrogén |
14 |
14 |
17,5 |
17,54 |
0,9722 |
0,969(3) |
29,652 |
29,56 |
(3)Dr. W. Biotés Arrago nyomán |
| foszfor |
14 |
14 |
17,5 |
17,4(4) |
0,9722 |
-- |
29,652 |
-- |
(4)Dr. W. Berzelius és Rose nyomán |
| oxigén |
16 |
8 |
10 |
10 |
1,1111 |
1,104(5) |
33,888 |
33,672 |
(5)Dr. Thomson, több kísérlet átlagából |
| kén |
16 |
16 |
20 |
20(6) |
1,1111 |
-- |
33,888 |
-- |
(6)Dr. W. Berzelius nyomán |
| kalcium |
20 |
20 |
25 |
25,46(7) |
1,3888 |
-- |
42,36 |
-- |
(7)Dr. W. kísérlet alapján |
| nátrium |
24 |
24 |
30 |
29,1(8) |
1,6666 |
-- |
50,832 |
-- |
(8)Dr. W. Davy nyomán |
| vas |
28 |
28 |
35 |
34,5(9) |
1,9444 |
-- |
59,302 |
-- |
(9)Dr. W. Thenard és Berzelius nyomán |
| cink |
32 |
32 |
40 |
41(10) |
2,222 |
-- |
67,777 |
-- |
(10)Dr. W. Gay-Lussac nyomán |
| klór |
36 |
36 |
45 |
44,1(11) |
2,5 |
2,483(12) |
76,248 |
-- |
(11)Dr. W. Berzelius nyomán |
|
|
|
|
|
|
|
|
|
(12)Dr. Thomson, Annals of Philosophy, IV. 13. |
| kálium |
40 |
40 |
50 |
49,1(13) |
2,7777 |
-- |
84,72 |
-- |
(13)Dr. W. Berzelius nyomán |
| bárium |
70 |
70 |
87,5 |
87(14) |
4,8611 |
-- |
148,26 |
-- |
(14)Dr. W. Berzelius és Klaproth nyomán |
| jód |
124 |
124 |
155 |
156,21(15) |
8,6111 |
-- |
262,632 |
-- |
(15)Gay-Lussac, Ann. de Chim. XCI. 5. |
* A szerzô a nyomást valószínûleg
Hg-hüvelykben adja meg, 1 bar kb. 30 Hg-hüvelyk; a hômérsékletet
feltehetôen Fahrenheitben méri, 60 oF kb. 15,6
oC-nak
felel meg.
2. táblázat.
Oxigénnel alkotott kombinációk
3. táblázat.
Hidrogénnel alkotott vegyületek
4. táblázat.
Analógiás alapon kezelt anyagok, amelyek adatai még
bizonytalanok
[A táblázatok – a letöltés megkönnyítése
miatt – külön lapokon szerepelnek.]
Megjegyzések
1. táblázat. Ez – és a többi táblázat
is – könnyen érthetô. Az elsô oszlopban a különbözô
anyagok gázállapotra vonatkozó fajsúlyai szerepelnek,
feltéve, hogy a hidrogén 1. Ha feltesszük, hogy a térfogat
47,21435 köbhüvelyk, a számok megegyeznek az ilyen mennyiségû
gázok granumban kifejezett súlyával. A harmadik oszlopba
azok a számított értékek kerültek, amelyeknél
– Dr. Thomson, Dr. Wollaston és mások javaslatára
– feltettem, hogy az oxigén atomja 10; a negyedikben kísérleti
adatok szerepelnek az elôzô feltevés mellett. Látható,
hogy a két oszlop milyen jól egyezik. Az említett
anyagokhoz – a jód kivételével – nincs hozzáfûzni
valóm. Csak egyetlen kísérletet végeztem, hogy
megállapítsam ezen anyag atomjának súlyát,
ezért a bemutatott eredmények megbízhatóságát
csekélynek tarthatnánk. Valóban ez lenne a helyzet,
ha az adatok nem egyeznének olyan jól Gay-Lussac kísérleteivel.
2. táblázat. Ez a táblázat számos
esetben feltûnô egyezést mutat az elmélet és
a kísérlet között. Látható, hogy
Gay-Lussac gondolatai elfogadásra kerültek, vagy inkább
anticipálódtak, mivel a táblázat nagy részét
már azelôtt elkészítettem, hogy elolvashattam
volna jódról szóló közleményének
utolsó részét. A táblázat egy-két
szembeszökô példát is mutat azokra a hibákra,
amelyek abból erednek, hogy nem értik meg jól a térfogatok
és atomok tana közötti kapcsolatot. Így például
azt mondják, hogy az ammónia egy atom nitrogénbôl
és csak 1,5 hidrogénbôl keletkezik úgy, hogy
az atomok két térfogatba sûrûsödnek, ami
egy atomnak felel meg. Ez az oka annak, hogy ez az anyag – néhány
másikhoz hasonlóan – nyilvánvalóan kétszeres
mennyiségben vegyül. [12]
3. táblázat. Ez a táblázat is mutat
néhány feltûnô egyezést az elôzôhöz
hasonlóan. Sôt azt is észrevettem – még mielôtt
a problémával foglalkozni kezdtem volna –, hogy számos
atom súlya milyen közel esik a kerek számokhoz. Úgy
tûnik, Dr. Thomson is felfigyelt erre. Azt is érdemes megjegyezni,
hogy a három mágneses fém – ahogy Dr. Thomson rámutatott
– azonos súlyú, pontosan a nitrogén kétszerese.
A nagyjából azonos súlyú anyagok könnyen
vegyülnek, és tulajdonságaik is némiképp
hasonlóak.
A táblázatokról összegzésképpen
azt mondhatjuk, hogy
1. Ha a hidrogént 1-nek tekintjük, minden elem száma
osztható 4-gyel, kivéve a szenet, a nitrogént és
a báriumot, amely 2-vel osztható, ami feltehetôen azt
jelzi, hogy az egységnél vagy a hidrogénénél
nagyobb szám jut érvényre bennük. Ez a másik
szám a 16 vagy az oxigén? És minden anyag ebbôl
a két elembôl áll?
2. Úgy látszik, az oxigén nem vegyül két
térfogat vagy négy atom arányában.
3. Minden gáz – még a lehetô legteljesebb szárítás
után is – tartalmaz vizet, amelynek a mennyiségét,
feltéve, hogy a jelenlegi elgondolások helyesek, igen nagy
pontossággal meg lehet határozni.
Kétségtelen, hogy mást is meg lehetne említeni,
ám az anyagot inkább a kémikus világ vizsgálatára
bocsátom.
[1] Legyen az oxigén fajsúlya = x
és 22,22 = a,
a nitrogén fajsúlya = y és 77,77 = b.
Ekkor (x+4y)/5 = 1 és x:4y = a:b.
Innen: 5-4y = 4ay/b, tehát
y = 5b/(4a+4b) = 0,9722 és x = 5-4y = 1,11111.
(Megjegyzés: az angol szakirodalomban fajsúlyon
gyakran relatív sûrûséget értenek; a cikkbeli
adatok – mint ki is derül – a levegô sûrûségére
vonatkoznak. Szerk.)
[2] Legyen a hidrogén fajsúlya = x.
Ekkor (3x+0,9722)/2 = 0,5902.
Tehát x = (1,1804-0,9722)/3 = 0,0694.
[3] 1,11111 / 0,0694 = 16 és 0,9722 / 0,0694
= 14.
[4] Mivel 1,104 : 1,11111 = 1,278 :1,286
és 0,969 : 0,9722 = 1,278 : 1,283. Ezek átlaga: 1,2845.
[5] Legyen a klór fajsúlya = x.
Ekkor (x+0,0694)/2 = 1,2845.
És jó közelítéssel x = 2,569-0,0694
= 2,5.
[6] Annals of Philosophy, Vol. IV. p. 13.
[7] Ibid, Vol. VI. p. 126.
[8] Mivel 25,8 : 100 = 40:155. A 8. pontban leírt
kísérlet szerint egy atom cink súlya 40. Dr. Thomson
40,9-nek veszi, ami alig különbözik. Lásd Annals
of Philosophy, Vol. IV. p. 94.
[9] Gay-Lussac úr szerint egy térfogat
hidrogén csak fél térfogat oxigénnel, de egy
teljes térfogat jóddal vegyül. Ezért az oxigén
és a jód közötti térfogatarány 1/2
: 1, a súlyarány pedig 1 : 15,5. Ha 0,5555-öt, a fél
térfogat oxigén sûrûségét megszorozzuk
15,5-tel, 8,61111-et kapunk, és 8,61111 / 0,06944 = 124. Általában
tehát bármely anyag gázállapotbeli fajsúlyát
egyszerûen úgy kapjuk meg, hogy az oxigén fajsúlyának
felét megszorozzuk az anyag atomjának oxigénre vonatkoztatott
súlyával. Lásd Annals of Philosophy, Vol. V.
p. 105.
[10] Egyes kísérleteim 20-hoz közelebbi
értéket adtak a foszfor és 40-hez közelebbit
a foszforsav esetében.
[11] Dr. Thomson adataira támaszkodom, Annals
of Philosophy, Vol. III, p. 376. Dr. Wollaston kissé különbözô
értékeket közöl, amennyiben a kalcium-karbonát
43,7 szén-dioxidból and 56,3 rész kalcium-oxidból
áll, Phil. Trans. Vol. CIV. p. 8.
[12] Lásd Gay-Lussac közleményét
a jódról, Annals of Philosophy, VI. 189.
* Úgy látszik, Prout az N2O
képletet Dalton NO összetételû nitrogén-oxidja
alapján írta fel, de a nitrogénre más atomsúlyt
használt. Szerk. (vissza)
A testek gázállapotbeli fajsúlya
és atomjainak súlya közötti kapcsolatról
írt tanulmány egy hibájának javítása
Annals of Philosophy 7, 111-3 (1816) [név nélkül
jelent meg]
(David M. Knight, ed., Classical Scientific Papers--Chemistry, Second
Series, 1970)
A testek gázállapotbeli fajsúlya és atomjainak
súlya közötti kapcsolatról írt tanulmány
szerzôje sietve igyekszik kijavítani egy tévedést,
amely a szóban forgó tanulmány (Vol. VI. p. 328) harmadik
táblázatának néhány számát
érinti. Ez a tévedés minden táblázat
harmadik oszlopának fejlécében megtalálható,
és azt az állítást tartalmazza, hogy a hidrogén
atomja egy helyett két térfogatból áll. A táblázatok
az elôzô feltevés mellett készültek, kivéve
a harmadik táblázat alább javított adatait
...
| Név |
Fajsúly (hidrogén
= 1) |
Az atom súlya
(hid-
rogén
=1) |
Az atom súlya
(oxigén
= 10) |
Az atom súlya
(oxigén
= 10, kí-
sérletbôl) |
Fajsúly (légköri levegô = 1) |
Fajsúly (légköri levegô = 1,
kí-
sérletbôl) |
100 köb-
hüvelyk súlya (barom. 30, hôm. 60) |
100 köb-
hüvelyk súlya (kísérlet-
bôl) |
Elemek térfogat szerint |
A térf. száma vegyülés után |
Elemek súly szerint |
Megjegyzés |
| szénhidrogén* |
8 |
4 |
5 |
5,09 |
0,5555 |
0,5555(1) |
16,999 |
16,999 |
1 hid + 0,5 szén |
0,5 |
1 hid + 0,5 szén |
(1)Dr. Thomson |
| olefines gáz |
14 |
7 |
8,75 |
8,86 |
0,9722 |
0,9740(1) |
29,652 |
29,72 |
1 hid + 1 szén |
0,5 |
1 hid + 1 szén |
|
| kénhidrogén |
17 |
17 |
21,25 |
21,32 |
1,1805 |
1,177 |
36,006 |
35,89 |
1 hid + 1 kén |
1 |
1 hid + 1 kén |
|
| sósav |
18,5 |
37 |
46,25 |
45,42 |
1,284 |
1,278 |
39,183 |
38,979 |
1 hid + 1 klór |
2 |
1 hid + 1 klór |
|
| jódhidrogén |
62,5 |
125 |
156,25 |
157,53 |
4,3402 |
4,3463(2) |
132,375 |
-- |
1 hid + 1 jód |
2 |
1 hid + 1 jód |
(2)Gay-Lussac |
| ammónia |
8,5 |
17 |
21,25 |
21,5(3) |
0,5902(4) |
0,5900 |
18,003 |
18,000 |
3 hid + 1 nit |
2 |
3 hid + 1 nit |
(3)Dr. Wollaston |
|
|
|
|
|
|
|
|
|
|
|
|
(4)Sir H. Davy |
| ciángáz |
26 |
26 |
32,5 |
32,52 |
1,8055 |
1,8064(5) |
55,068 |
-- |
2 szén + 1 nit |
1 |
2 szén + 1 nit |
(5)Gay-Lussac, Ann. de Chim. Aug. 1815. |
| ciánhidrogén |
13,5 |
27 |
33,75 |
33,846 |
0,9374 |
0,9360(5) |
28,593 |
-- |
1 cia + 1 hid |
2 |
1 cia + 1 hid |
|
| ciánklorid |
31 |
62 |
77,5 |
-- |
2,1527 |
2,1111(5) |
65,659 |
-- |
1 cia + 1 klór |
2 |
1 cia + 1 klór |
|
* [A szénhidrogén – a megadott adatok alapján –
CH2-nek felel meg, az olefines gáz C2H2,
a jódhidrogén HI, a ciángáz C2N2,
a ciánhidrogén HCN, a ciánklorid CNCl.]
A táblázatban az is megfigyelhetô, hogy belekerültek
Gay-Lussac ciánhidrogénre stb. vonatkozó új
meghatározásai, amelyek megfelelnek a fent hivatkozott tanulmány
gondolatainak és még inkább alátámasztják
azokat.
Azért is elônyös a hidrogén térfogatát
egyezônek tekinteni az atoméval, mert például
a legtöbb – vagy talán az összes – elemi anyag esetében
a fajsúlyok (feltéve, hogy a hidrogén 1) vagy pontosan
egybeesnek atomjaik súlyával, vagy atomjaik súlyainak
valamely többszörösei; ha azonban az oxigén térfogatát
tekintjük egységnyinek, a legtöbb elemi anyag atomjának
súlya – az oxigén kivételével – kétszerese
lesz a testek gázállapotbeli fajsúlyának (amit
akár a hidrogénre, akár a légköri levegôre
vonatkoztatunk) Dr. Wollaston skálája alapján.
Ha azok az elgondolások, amelyekre bátorkodtunk
jutni, helyesek, szinte azt mondhatjuk, hogy az ókoriak 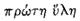 -je
[próté hülé-je, elsôdleges anyaga]
a hidrogénben ölt testet, bár ez a vélekedés
– most jut eszembe – nem egészen új**.Ha
feltesszük, hogy ezzel állunk szemben, és azt is feltesszük,
hogy a testek gázállapotbeli fajsúlya az egy térfogatba
sûrûsödött térfogatok számát
vagy – más szóval – a bennük levô elsôdleges
anyag (
-je
[próté hülé-je, elsôdleges anyaga]
a hidrogénben ölt testet, bár ez a vélekedés
– most jut eszembe – nem egészen új**.Ha
feltesszük, hogy ezzel állunk szemben, és azt is feltesszük,
hogy a testek gázállapotbeli fajsúlya az egy térfogatba
sûrûsödött térfogatok számát
vagy – más szóval – a bennük levô elsôdleges
anyag (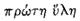 ) egyetlen térfogata
abszolút súlyának a számát jelöli,
ami rendkívül valószínû, a súlyok
többszöröseinek mindig a térfogatok többszöröseit
kell jelezniük, és fordítva, és az összes
test gázállapotbeli fajsúlyának vagy abszolút
súlyának az elsôdleges anyag (
) egyetlen térfogata
abszolút súlyának a számát jelöli,
ami rendkívül valószínû, a súlyok
többszöröseinek mindig a térfogatok többszöröseit
kell jelezniük, és fordítva, és az összes
test gázállapotbeli fajsúlyának vagy abszolút
súlyának az elsôdleges anyag (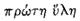 )
fajsúlya vagy abszolút súlya többszörösének
kell lennie, mert gázállapotban minden test, amely egyesül
a másikkal, a térfogata szerint egyesül.
)
fajsúlya vagy abszolút súlya többszörösének
kell lennie, mert gázállapotban minden test, amely egyesül
a másikkal, a térfogata szerint egyesül.
** [Prout itt Davy 1812-es megjegyzésére
utalhat. Davy a hidrogénrõl a következõt írta:
"...rendkívüli könnyûsége és a vegyületekben
megjelenõ kicsiny mennyisége miatt valószínûtlen,
hogy a jelenleg rendelkezésünkre álló eljárásokkal
vagy eszközökkel felbonthatnánk nem-súlytalan alkotórészekre."
A fémek és az éghetõ testek Davy szerint "úgy
foghatók fel, mint a hidrogén és egy eddig ismeretlen
szubsztancia különféle kombinációi. ...
Nem lehetetlen, hogy ugyanabból a nem-súlytalan anyagfajtából
– különbözõ elektromos állapotban vagy különbözõ
elrendezésben – kémiailag különbözõ
anyagok keletkezhetnek." ]
Néhány relatív atomtömeg közelítô
értéke
| alumínium |
27 |
arany |
197 |
arzén |
75 |
bárium |
137 |
cink |
65 |
foszfor |
31 |
| jód |
127 |
kalcium |
40 |
kálium |
39 |
kén |
32 |
klór |
35,5 |
kobalt |
59 |
| króm |
52 |
magnézium |
24 |
mangán |
55 |
molibdén |
96 |
nátrium |
23 |
nikkel |
59 |
| nitrogén |
14 |
ólom |
207 |
ón |
119 |
oxigén |
16 |
platina |
195 |
réz |
63,5 |
| stroncium |
88 |
szén |
12 |
tellúr |
128 |
urán |
238 |
vas |
56 |
volfrám |
184 |
| ChemoNet, 1997
Vissza |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |
 A következô
tanulmány szerzôje a legnagyobb félénkséggel
tárja írását a nyilvánosság elé,
mert bár minden erejével a tudományos igazságra
törkedett, kísérleti emberként nem bízik
annyira képességeiben, hogy másoknak sokkal többet
merjen mondani annál, mintsem majd eldôl, mennyire fontos
az eredménye, és ha valaki hajlandó lesz azt megvizsgálni,
következtetéseit majd alátámasztja vagy elutasítja.
Ha a következtetések hibásnak bizonyulnának,
még mindig napvilágra kerülhetnek új tények
vagy a régiek válhatnak megalapozottabbakká; de ha
sikerülne ôket igazolni, a kémia egész tudománya
kerülne új és érdekes megvilágításba.
A következô
tanulmány szerzôje a legnagyobb félénkséggel
tárja írását a nyilvánosság elé,
mert bár minden erejével a tudományos igazságra
törkedett, kísérleti emberként nem bízik
annyira képességeiben, hogy másoknak sokkal többet
merjen mondani annál, mintsem majd eldôl, mennyire fontos
az eredménye, és ha valaki hajlandó lesz azt megvizsgálni,
következtetéseit majd alátámasztja vagy elutasítja.
Ha a következtetések hibásnak bizonyulnának,
még mindig napvilágra kerülhetnek új tények
vagy a régiek válhatnak megalapozottabbakká; de ha
sikerülne ôket igazolni, a kémia egész tudománya
kerülne új és érdekes megvilágításba.