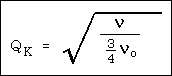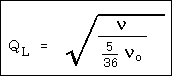Henry Gwyn Jeffrey Moseley
(1887-1915)
Az elemek nagyfrekvenciás spektruma
(The
High Frequency Spectra of the Elements)
Phil. Mag. (1913), p. 1024
(A ChemTeam
gyûjteményébôl)
 Miután
semmilyen módszer nem áll rendelkezésre a spektrumanalízishez,
azokat a jellegzetes Röntgen-sugár fajtákat, amelyeket
a megfelelôen gerjesztett atomok kibocsájtanak, eddig csak
az alumíniumban lejátszódó abszorpciójuk
alapján írták le. Azok az interferencia-jelenségek
azonban, amelyeket a kristályokon szóródó Röntgen-sugarak
mutatnak, most már lehetôvé teszik a különbözô
fajta sugárzások frekvenciáinak pontos meghatározását.
Ezt W. H. és W. L. Bragg mutatta ki, akik ezzel a módszerrel
elemezték egy Röntgen-csô platinatargetjének vonalas
spektrumát. C. G. Darwin és a szerzô kiterjesztette
ezt a vizsgálatot, és a folytonos spektrumot is elemezte,
amely ebben az esetben a sugárzás nagyobbik részét
alkotja. Nemrégiben Bragg professzor is meghatározta a nikkel,
a volfrám és a ródium spektrumában a legerôsebb
vonalak hullámhosszát. Az eddig alkalmazott elektromos módszerek
azonban csak akkor eredményesek, ha állandó sugárforrás
áll rendelkezésre. Jelen dolgozat ismertet egy eljárást
ezeknek a spektrumoknak a lefényképezésére,
ami olyan egyszerûvé teszi a Röntgen-sugarak elemzését,
mint a spektroszkópia más ágáét. A szerzô
elôször a nagyfrekvenciás sugárzás fô
fajtáit kívánja átfogóan ismertetni,
majd az eddiginél nagyobb részletességgel és
pontossággal vizsgálja meg néhány elem spektrumát.
Az eddigi eredmények arra utalnak, hogy ezek az adatok igen fontosak
az atomok belsô szerkezetének feltárásában,
és alaposan alátámasztják
Rutherford
és Bohr elméletét.
Miután
semmilyen módszer nem áll rendelkezésre a spektrumanalízishez,
azokat a jellegzetes Röntgen-sugár fajtákat, amelyeket
a megfelelôen gerjesztett atomok kibocsájtanak, eddig csak
az alumíniumban lejátszódó abszorpciójuk
alapján írták le. Azok az interferencia-jelenségek
azonban, amelyeket a kristályokon szóródó Röntgen-sugarak
mutatnak, most már lehetôvé teszik a különbözô
fajta sugárzások frekvenciáinak pontos meghatározását.
Ezt W. H. és W. L. Bragg mutatta ki, akik ezzel a módszerrel
elemezték egy Röntgen-csô platinatargetjének vonalas
spektrumát. C. G. Darwin és a szerzô kiterjesztette
ezt a vizsgálatot, és a folytonos spektrumot is elemezte,
amely ebben az esetben a sugárzás nagyobbik részét
alkotja. Nemrégiben Bragg professzor is meghatározta a nikkel,
a volfrám és a ródium spektrumában a legerôsebb
vonalak hullámhosszát. Az eddig alkalmazott elektromos módszerek
azonban csak akkor eredményesek, ha állandó sugárforrás
áll rendelkezésre. Jelen dolgozat ismertet egy eljárást
ezeknek a spektrumoknak a lefényképezésére,
ami olyan egyszerûvé teszi a Röntgen-sugarak elemzését,
mint a spektroszkópia más ágáét. A szerzô
elôször a nagyfrekvenciás sugárzás fô
fajtáit kívánja átfogóan ismertetni,
majd az eddiginél nagyobb részletességgel és
pontossággal vizsgálja meg néhány elem spektrumát.
Az eddigi eredmények arra utalnak, hogy ezek az adatok igen fontosak
az atomok belsô szerkezetének feltárásában,
és alaposan alátámasztják
Rutherford
és Bohr elméletét.
 Kaye
mutatta ki, hogy az elegendôen gyors katódsugárnyalábbal
gerjesztett elemek karakterisztikus Röntgen-sugárzást
bocsájtanak ki. Vizsgálataihoz számos anyagot használt
targetként. A céltárgyakat evakuált csôben
elhelyezett kocsira erôsítette, és mágneses
berendezéssel állította a sugárzás irányába.
A készüléket a jelen munka céljaira módosítottuk.
A katódból érkezô nyalábot a target egy
kis felületére koncentráltuk, és keskeny függôleges
réssel ellátott platinalemezt tettünk közvetlenül
a bombázott rész elé. A csövet Gaede-féle
higanyszivattyúval evakuáltuk, néha cseppfolyós
levegôbe helyezett faszenet is használtunk a vízgôz
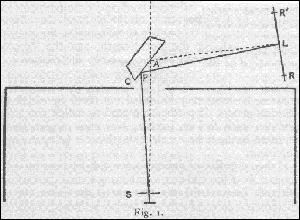
eltávolítására. A Röntgen-sugarak - az
ábrán S-sel jelzett résen áthaladva - egy 0,02
mm vastag alumíniumablakon léptek ki. A sugárzás
többi részét a csövet körülvevô
ólomdoboz nyelte el. A sugarak egy spektrométer prizma-asztalára
szerelt kálium-ferrocianid kristály C hasadási síkjára
estek. A kristály felülete függôleges volt, és
a spektrométer geometriai tengelye áthaladt rajta.
Kaye
mutatta ki, hogy az elegendôen gyors katódsugárnyalábbal
gerjesztett elemek karakterisztikus Röntgen-sugárzást
bocsájtanak ki. Vizsgálataihoz számos anyagot használt
targetként. A céltárgyakat evakuált csôben
elhelyezett kocsira erôsítette, és mágneses
berendezéssel állította a sugárzás irányába.
A készüléket a jelen munka céljaira módosítottuk.
A katódból érkezô nyalábot a target egy
kis felületére koncentráltuk, és keskeny függôleges
réssel ellátott platinalemezt tettünk közvetlenül
a bombázott rész elé. A csövet Gaede-féle
higanyszivattyúval evakuáltuk, néha cseppfolyós
levegôbe helyezett faszenet is használtunk a vízgôz
eltávolítására. A Röntgen-sugarak - az
ábrán S-sel jelzett résen áthaladva - egy 0,02
mm vastag alumíniumablakon léptek ki. A sugárzás
többi részét a csövet körülvevô
ólomdoboz nyelte el. A sugarak egy spektrométer prizma-asztalára
szerelt kálium-ferrocianid kristály C hasadási síkjára
estek. A kristály felülete függôleges volt, és
a spektrométer geometriai tengelye áthaladt rajta.
Ismert, hogy a Röntgen-sugarak általában heterogén
sugárzásból és adott frekvenciájú
karakterisztikus sugárzásokból állnak. Az elôzô
olyan felületrôl verôdik vissza, amelyet mindeféle
beesési szög alatt ér a sugárzás, de a
jelen munkában alkalmazott nagy szögek esetén ennek
intenzitása nagyon csekély. Az adott frekvenciájú
sugarak azonban csak akkor verôdnek vissza, ha meghatározott
szögben érik a felületet. A beesô sugárzás
kristálysíkkal bezárt szöge,q,
a hullámhossz és a kristály d "rácsállandója"
a következô kapcsolatban áll egymással:
n l = 2d
sin q
ahol az n egész szám a visszaverôdés
"rendjének" nevezhetô. Az általunk használt
ritka, 6 cm2-es lappal rendelkezô kristályról
ismeretes volt, hogy az elsô három rendben ad erôs reflexiót,
a harmadik rend a legerôteljesebb.
Ha tehát egy adott hullámhosszú sugárzás
a kristály bármely P részét megfelelô
szögben éri, egy kis része visszaverôdik. Tegyük
fel egyelôre, hogy a sugárforrás pontszerû, P
ekkor nyilvánvalóan egy köríven van, és
a visszavert sugarak egy olyan kúp alkotói, amelynek a csúcsa
a forrás képe. Az L fényképezôlemezen
hiperbola jelenik meg, amely a beesô sugár irányától
elhajlik. A keskeny S rés alkalmazása miatt az ívbôl
vékony vonal lesz, amely a jelzett irányban kissé
görbül.
A fényképezôlemezt a spektrométer karjára
szereltük. A lemez és a rés is 17 cm-re volt a tengelytôl.
Ez az elrendezés geometriai szempontból fontos, mert ha ez
a két távolság egyenlô, az az L pont, amelynél
az adott szögben visszavert sugár a lemezt éri, független
a kristály felületén levô P helyzetétôl.
A kristály beállítási szöge közömbös,
ha a sugár a megfelelô szögben még eléri
a felület valamely részét. A q
szög a következô egyenletôl határozható
meg: 2q = 180o - SPL = 180o
- SAL.
Az SAL szöget a következô módon mértük
meg. A fénykép elkészítése elôtt
a lemez mindkét végén egy-egy R referencia vonalat
vettünk fel úgy, hogy a kristály helyére egy
keskeny réssel ellátott ólomernyôt tettünk.
A rés egybeesett a spektrométer tengelyével. Néhány
másodperces Röntgen-sugaras exponálás után
megjelent a lemezen a R vonal, ami meghatározta rajta az S és
A közötti vonalat. Ugyanígy egy másik RQ vonalat
is felvettünk, miután a spektrométer karját adott
szögben elforgattuk. A kart ezután olyan helyzetbe forgattuk,
hogy a visszavert sugarat és az LAP szögeket minden egyes vonalra
megkapjuk, amely ezután a lemezre került. D-t 1o-os
közökben határoztuk meg úgy, hogy a negatívra
egy olyan fényképezôlemezt tettünk, amelyen a
referencia vonalakat ugyanilyen módon jelöltük meg. A
beesô sugárzás kristálysíkkal bezárt
szögének meghatározásához két apró
korrekciót is el kellett végezni, mert sem a kristálylap,
sem az ólom rése nem esett pontosan egybe a spektrométer
tengelyével. Egy adott kristályorinetáció mellett
egymástól körülbelül 30%-nyira eltérô
hullámhosszú sugarak verôdtek vissza róla.
Az expozíciós idô szinte minden esetben öt
perc volt. Ilford-féle Röntgen-sugár lemezeket használtunk,
és a képet rodinállal hívtuk elô. A lemezeket
olyan lemeztartóba szereltük, amelynek az elejét fekete
papír borította. A hullámhosszat a q
visszaverôdési szögbôl a reflexió n rendje
és a d rácsállandó ismeretében
lehet meghatározni. n-et úgy kaptuk meg, hogy minden
spektrumot másod- és harmadrendben is lefényképeztünk.
Ez a mérések pontosságának ellenôrzése
miatt is hasznos volt. A d nem számítható ki
közvetlenül a bonyolult kálium-ferrocianid kristályra.
A kristály rácsállandóját azonban elôzôleg
már pontosan összehasonlították egy kôsókristály
d'
állandójával, és azt találták,
hogy
d = 3 d' · 0,1988 / 0,1985
W. L. Bragg kimutatta, hogy a kôsó kristály atomjai
egyszerû köbös elrendezést vesznek fel. Ezért
az 1 cm3-ben lévô atomok számára
teljesül, hogy
2 Ns / M = 1
/ (d')3
ahol N, a gramm-molekulasúlynyi anyagban levô molekulák
száma, = 6,05 · 1023, feltéve, hogy az
elektron töltése 4,89 · 10-10; s,
ennek a kôsónak a sûrûsége 2,167 volt,
és M, a molekulasúly, = 58,46.
Ebbôl d' = 2,814 · 10-8 and d
= 8,454 · 10-8 cm. Látható, hogy a hullámhossz-meghatározásban
nem játszik fontos szerepet ennek az értéknek a bizonytalansága.
A kristály homogenitásának hiánya valószínûbb
hibaforrás, hiszen a kis vízzárványok miatt
a sûrûség nagyobb lehet a kísérletben
meghatározott értéknél.
Eddig tizenkét elemet vizsgáltunk meg....
Az V. ábra a harmadrendben visszaverôdött spektrumokat
mutatja. (A spektrumokat nem közöljük. Szerk.) ...
Látható, hogy minden elem spektruma két vonalból
áll. Az erôsebbeket a, a gyengébbeket
b
jelzi. A lemezeken az a- és b-vonalakon
kívül minden vonal szinte biztosan szennyezôdés
következménye. A kobalt-spektrum mind másod-, mind harmadrendben
nagyon erôs Nia és halvány
Fea vonalat mutat. A nikkel spektrumán
harmadrendben halvány Mna
látható. A sárgaréz spektrumában természetesen
megjelenik a Cu és a Zn
a- és
b-vonala, de a Znb2
nem látható. Másodrendben a ferrovanádium és
a ferrotitán spektrum igen erôs harmadrendû Fe-vonalakat
mutat, és az elôbbiben halvány Cua3
is megjelenik. A Co Ni-t és 0,8% Fe-t, a Ni 2,2% Mn-t, a V csak
nyomnyi Cu-t tartalmazott. Más vonalak nem tûntek fel, de
csak egy vagy két elem esetében végeztünk széles
hullámhossz-tartományra kiterjedô vizsgálatokat,
és a hosszabb expozíció nyomán, amelyet eddig
még kíséreltünk meg, bonyolultabb spektrumok
jelenhetnek meg. A szennyezôdések miatti nagyszámú
vonal arra utal, hogy a módszer a kémiai elemzés hatékony
eszköze lehet. A közönséges spektroszkópiai
módszernél azért elônyösebb, mert a spektrumok
egyszerûek, és lehetetlen, hogy az egyik anyag elfedje a másikból
származó sugárzást. Az eljárás
akár hiányzó elemek felfedezéséhez is
vezethet, mert ezek karakterisztikus vonalait meg lehet majd jósolni....
Phil. Mag. (1914), p. 703.
 |
|
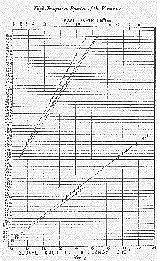
3. ábra
|
A dolgozat elsô része a Röntgen-spektrumok fényképezésével
foglalkozott, és egy tucat elem spektrumát tartalmazta. Azóta
több mint harminc újabb elemet is megvizsgáltunk, és
úgy találtuk, hogy az eredmények egyszerû törvényeknek
engedelmeskednek. A törvények alapján az is biztonsággal
megjósolható - az alumíniumtól az aranyig -
bármely elem spektrumában, hogy hová kerülnek
a fô vonalak. A jelen közlemény csak általános,
elôzetes beszámoló, amely se teljességre, se
nagy pontosságra nem törekszik....
Az 1. táblázatban láthatók azok az eredmények,
amelyeket a Barkla-féle K-sorozathoz
tartozó sugárzásokra kaptunk. [...] A l
hullámhosszat
a reflexió kristálysíkkal bezárt q
szögébôl számítottuk ki az nl
= 2d sinq összefüggésbôl,
ahol d-t 8,454 · 10-8 cm-nek vettük. A korábbihoz
hasonlóan a legerôsebb vonalat a-val,
a következôt b-val jelöltük.
Az egyes vonalak frekvenciájának négyzetgyöke
a 3. ábrán szerepel; a hullámhosszak a diagram tetején
levô skála segítségével olvashatók
le. (A jól látható, gif formátumú ábra
kb. 130K, külön tölthetô le. Szerk.)
| 1. táblázat |
| |
a-vonal
l ·108 cm |
QK |
N, az atom
száma |
b-vonal
l ·108 cm |
| alumínium |
8.364 |
12.05 |
13 |
7.912 |
| szilícium |
7,142 |
13,04 |
14 |
6,729 |
| klór |
4,750 |
16,00 |
17 |
------- |
| kálium |
3,759 |
17,98 |
19 |
3,463 |
| kalcium |
3,368 |
19,00 |
20 |
3,094 |
| titán |
2,758 |
20,99 |
22 |
2,524 |
| vanádium |
2,519 |
21,96 |
23 |
2,297 |
| króm |
2,301 |
22,98 |
24 |
2,093 |
| mangán |
2,111 |
23,99 |
25 |
1,818 |
| vas |
1,946 |
24,99 |
26 |
1,765 |
| kobalt |
1,798 |
26,00 |
27 |
1,629 |
| nikkel |
1,662 |
27,04 |
28 |
1,506 |
| réz |
1,549 |
28,01 |
29 |
1,402 |
| cink |
1,445 |
29,01 |
30 |
1,306 |
| ittrium |
0,838 |
38,1 |
39 |
------- |
| cirkónium |
0,794 |
39,1 |
40 |
------- |
| nióbium |
0,750 |
40,2 |
41 |
------- |
| molibdén |
0,721 |
41,2 |
42 |
------- |
| ruténium |
0,638 |
43,6 |
44 |
------- |
| palládium |
0,584 |
45,6 |
46 |
------- |
| ezüst |
0,560 |
46,6 |
47 |
------- |
Az Al spektrumát csak elsô rendben fényképeztük
le. A nagyon könnyû elemek spektruma több más halvány
vonalat is mutat, amelyeket még nem vizsgáltunk meg részletesen.
A Mg és a Na spektruma igen bonyolult, és szemmel láthatóan
eltér azoktól az egyszerû összefüggésektôl,
amelyek a többi elem spektrumát egymással kapcsolatba
hozzák.
Az ittriummal kezdôdô spektrumokban eddig csak az a-vonalat
mértük ki, a további eredményeket egy késôbbi
dolgozatban közöljük. A K és a Cl spektrumát
KCl targettel vettük fel, de igen kevéssé valószínû,
hogy a megfigyelt vonalakat nem a megfelelô elemekhez rendeltük.
Úgy tûnik, hogy az Y után álló elemek
esetében az a-vonalak nagyon közeli
dubletbôl állnak, amit már Bragg is észlelt
a ródiumnál.
Az L-sorozat spektrumainak adatait a 2. táblázat és
a 3. ábra szemlélteti. Ezek a spektrumok öt - a,
b,
g, d,
e
- vonalat tartalmaznak; hullámhosszuk és intenzitásuk
a megadott sorrendben csökken. Az a-vonalak
hosszú hullámhosszú oldalán mindig feltûnik
egy halvány a'-vonal, egy igen gyenge
j-vonal
látható legalább a ritkaföldfémek b-
és g-vonala között, és
számos nagyon gyenge, a-nál nagyobb
hullámhosszú vonal is megjelenik. Az a-,
b-,
j- és g-vonalat
azzal a céllal mértük ki szisztematikusan, hogy megmegnézzük,
miként változik elemrôl elemre a spektrum. A táblázatból
hiányzó adatok mindössze azt jelentik, hogy a munkát
még nem fejeztük be. Az eddigi vizsgálatok szerint a
spektrumok annyira hasonlóak, hogy legalább az a-,
b-
és g-vonal kétségtelenül
mindig létezik. A g-vonalakat nem mindig
vettük fel, mert egyetlen lemezre korlátozott hullámhossz-tartomány
fényképezhetô le. A vonalakat néha gyengeségük
vagy a szennyezések vonalainak zavaró közelsége
miatt nem mértük ki....
| 2. táblázat |
| |
a-vonal
l ·108 cm |
QL |
N, az atom
száma |
b-vonal
l ·108 cm |
j-vonal
l ·108 cm |
g-vonal
l ·108 cm |
| cirkónium |
6,091 |
32,8 |
40 |
--- |
--- |
--- |
| nióbium |
5,749 |
33,8 |
41 |
5,507 |
--- |
--- |
| molibdén |
5,423 |
34,8 |
42 |
5,187 |
--- |
--- |
| ruténium |
4,861 |
36,7 |
44 |
4,660 |
--- |
--- |
| ródium |
4,622 |
37,7 |
45 |
--- |
--- |
--- |
| palládium |
4,385 |
38,7 |
46 |
4,168 |
--- |
3,928 |
| ezüst |
4,170 |
39,6 |
47 |
--- |
--- |
--- |
| ón |
3,619 |
42,6 |
50 |
--- |
--- |
--- |
| antimon |
3,458 |
43,6 |
51 |
3,245 |
--- |
--- |
| lantán |
2,676 |
49,5 |
57 |
2,471 |
2,424 |
2,313 |
| cérium |
2,567 |
50,6 |
58 |
2,366 |
2,315 |
2,209 |
| prazeodímium |
(2,471) |
51,5 |
59 |
2,265 |
--- |
--- |
| neodímium |
2,382 |
52,5 |
60 |
2,175 |
--- |
--- |
| szamárium |
2,208 |
54,5 |
62 |
2,008 |
1,972 |
1,893 |
| európium |
2,130 |
55,5 |
63 |
1,925 |
1,888 |
1,814 |
| gadolínium |
2,057 |
65,5 |
64 |
1,853 |
1,818 |
--- |
| holmium |
1,914 |
58,6 |
66 |
1,711 |
--- |
--- |
| erbium |
1,790 |
60,6 |
68 |
1,591 |
1,563 |
--- |
| tantál |
1,525 |
65,6 |
73 |
1,330 |
--- |
1,287 |
| volfrám |
1,486 |
66,5 |
74 |
--- |
--- |
--- |
| ozmium |
1,397 |
68,5 |
76 |
1,201 |
--- |
1,172 |
| irídium |
1,354 |
69,6 |
77 |
1,155 |
--- |
1,138 |
| platina |
1,316 |
70,6 |
78 |
1,121 |
--- |
1,104 |
| arany |
1,287 |
71,4 |
79 |
1,092 |
--- |
1,078 |
Következtetések
A 3. ábrán az elemek spektrumait egymástól
azonos távolságra elhelyezett, vízszintes vonalakon
tüntettük fel. Az elemek atomsúlyaik szerint követik
egymást az A [Ar], Co és Te kivételével, ahol
ez a rend nem egyezik meg a kémiai tulajdonságok rendjével.
Üres vonalat hagytunk egy-egy eddig ismeretlen elemnek a Mo és
a Ru, a Nd és a Sa [Sm], valamint a W és az Os között,
míg a Tm, amelyet Welsbach két alkotórészre
választott szét, két vonalat kapott. Ez az elrendezés
megfelel annak, hogy az egymást követô elemekhez egymást
követô, az elemekre jellemzô egész számokat
rendelünk. Ennek az elvnek az alapján a tizenharmadik elemhez,
az Al-hoz tartozó N egész számot 13-nak vettük.
A többi elemhez feltételezett N-értékeket a 3.
ábra bal oldalán tüntettük fel. Az eljárás
jogosságát az igazolja, hogy a Röntgen-spektrumok így
tökéletesen szabályos rendbe sorolhatók. A 3.
ábra vizsgálata azt mutatja, hogy mind a K-, mind az L-sorozat
minden kimért vonalára a n1/2-értékek
szabályos, egyenes vonallal közelíthetô görbére
esnek. Ugyanez még világosabban látható, ha
az 1. táblázat N értékeit QK értékeivel
hasonlítjuk össze:
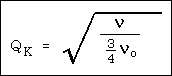
ahol n a vonal frekvenciája és
no
a fundamentális Rydberg-frekvencia. Jól látszik, hogy
nagyon jó közelítéssel QK = N - 1,
a nagyon rövid hullámhosszú sugárzások
kivételével, amelyek fokozatosan eltérnek ettôl
az összefüggéstôl. Ha a 2. táblázat
N értékeit a QL értékekkel hasonlítjuk
össze,
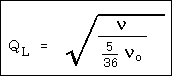
ahol n az La-vonal
frekvenciája, azt kapjuk, hogy közelítôleg QL
= N - 7,4, bár a szisztematikus eltérés mutatja, hogy
ebben az esetben az összefüggés nem pontosan lineáris.
Ha akár az elemekre nem jellemzôek ezek az egész
számok, akár a választott elrendezés vagy az
ismeretlen elemeknek kihagyott helyek száma hibás, ezek a
szabályszerûségek azonnal eltûnnek. Ezért
egyedül a Röntgen-spektrumok bizonysága alapján
- az atomszerkezetre vonatkozó elméletek felhasználása
nélkül - juthatunk arra a következtetésre, hogy
ezek az egész számok valóban jellemzôek az elemekre.
Továbbá, mivel nem valószínû, hogy két
különbözô stabil elemnek ugyanaz legyen az egész
száma, három - és csak három - további
elem létezése valószínû az Al és
a Au között. Miután ezeknek az elemeknek a Röntgen-spektruma
megbízhatóan megjósolható, az elemeket feltehetôen
nem nehéz megtalálni. A keltium vizsgálata kivételesen
érdekes lenne, mert ehhez az elemhez nem rendeltünk helyet.
Rutherford bebizonyította, hogy az
atom legfontosabb része a középsô, pozitív
töltésû mag; van den Broek
felvetette, hogy a magok töltése minden esetben a hidrogénmag
töltésének egész számú többszöröse.
Minden okunk megvan ahhoz a feltevéshez, hogy az az egész
szám, amely a Röntgen-spektrumokban érvényre
jut, ugyanaz, mint a magban levô elektromos egységek száma.
Ezek a kísérletek ezért a lehetô legalaposabban
alátámasztják van den Broek hipotézisét.
Soddy
kimutatta, hogy a radio-elemek kémiai tulajdonságai határozottan
bizonyítják, hogy ez a feltevés a talliumtól
az uránig igaz. Úgy tûnik, most a hipotézis
általános érvényességét alapoztuk
meg.
| ChemoNet, 1997
Vissza |
http://www.kfki.hu/chemonet/
http://www.ch.bme.hu/chemonet/ |
 Miután
semmilyen módszer nem áll rendelkezésre a spektrumanalízishez,
azokat a jellegzetes Röntgen-sugár fajtákat, amelyeket
a megfelelôen gerjesztett atomok kibocsájtanak, eddig csak
az alumíniumban lejátszódó abszorpciójuk
alapján írták le. Azok az interferencia-jelenségek
azonban, amelyeket a kristályokon szóródó Röntgen-sugarak
mutatnak, most már lehetôvé teszik a különbözô
fajta sugárzások frekvenciáinak pontos meghatározását.
Ezt W. H. és W. L. Bragg mutatta ki, akik ezzel a módszerrel
elemezték egy Röntgen-csô platinatargetjének vonalas
spektrumát. C. G. Darwin és a szerzô kiterjesztette
ezt a vizsgálatot, és a folytonos spektrumot is elemezte,
amely ebben az esetben a sugárzás nagyobbik részét
alkotja. Nemrégiben Bragg professzor is meghatározta a nikkel,
a volfrám és a ródium spektrumában a legerôsebb
vonalak hullámhosszát. Az eddig alkalmazott elektromos módszerek
azonban csak akkor eredményesek, ha állandó sugárforrás
áll rendelkezésre. Jelen dolgozat ismertet egy eljárást
ezeknek a spektrumoknak a lefényképezésére,
ami olyan egyszerûvé teszi a Röntgen-sugarak elemzését,
mint a spektroszkópia más ágáét. A szerzô
elôször a nagyfrekvenciás sugárzás fô
fajtáit kívánja átfogóan ismertetni,
majd az eddiginél nagyobb részletességgel és
pontossággal vizsgálja meg néhány elem spektrumát.
Az eddigi eredmények arra utalnak, hogy ezek az adatok igen fontosak
az atomok belsô szerkezetének feltárásában,
és alaposan alátámasztják
Rutherford
és Bohr elméletét.
Miután
semmilyen módszer nem áll rendelkezésre a spektrumanalízishez,
azokat a jellegzetes Röntgen-sugár fajtákat, amelyeket
a megfelelôen gerjesztett atomok kibocsájtanak, eddig csak
az alumíniumban lejátszódó abszorpciójuk
alapján írták le. Azok az interferencia-jelenségek
azonban, amelyeket a kristályokon szóródó Röntgen-sugarak
mutatnak, most már lehetôvé teszik a különbözô
fajta sugárzások frekvenciáinak pontos meghatározását.
Ezt W. H. és W. L. Bragg mutatta ki, akik ezzel a módszerrel
elemezték egy Röntgen-csô platinatargetjének vonalas
spektrumát. C. G. Darwin és a szerzô kiterjesztette
ezt a vizsgálatot, és a folytonos spektrumot is elemezte,
amely ebben az esetben a sugárzás nagyobbik részét
alkotja. Nemrégiben Bragg professzor is meghatározta a nikkel,
a volfrám és a ródium spektrumában a legerôsebb
vonalak hullámhosszát. Az eddig alkalmazott elektromos módszerek
azonban csak akkor eredményesek, ha állandó sugárforrás
áll rendelkezésre. Jelen dolgozat ismertet egy eljárást
ezeknek a spektrumoknak a lefényképezésére,
ami olyan egyszerûvé teszi a Röntgen-sugarak elemzését,
mint a spektroszkópia más ágáét. A szerzô
elôször a nagyfrekvenciás sugárzás fô
fajtáit kívánja átfogóan ismertetni,
majd az eddiginél nagyobb részletességgel és
pontossággal vizsgálja meg néhány elem spektrumát.
Az eddigi eredmények arra utalnak, hogy ezek az adatok igen fontosak
az atomok belsô szerkezetének feltárásában,
és alaposan alátámasztják
Rutherford
és Bohr elméletét.
 Kaye
mutatta ki, hogy az elegendôen gyors katódsugárnyalábbal
gerjesztett elemek karakterisztikus Röntgen-sugárzást
bocsájtanak ki. Vizsgálataihoz számos anyagot használt
targetként. A céltárgyakat evakuált csôben
elhelyezett kocsira erôsítette, és mágneses
berendezéssel állította a sugárzás irányába.
A készüléket a jelen munka céljaira módosítottuk.
A katódból érkezô nyalábot a target egy
kis felületére koncentráltuk, és keskeny függôleges
réssel ellátott platinalemezt tettünk közvetlenül
a bombázott rész elé. A csövet Gaede-féle
higanyszivattyúval evakuáltuk, néha cseppfolyós
levegôbe helyezett faszenet is használtunk a vízgôz
eltávolítására. A Röntgen-sugarak - az
ábrán S-sel jelzett résen áthaladva - egy 0,02
mm vastag alumíniumablakon léptek ki. A sugárzás
többi részét a csövet körülvevô
ólomdoboz nyelte el. A sugarak egy spektrométer prizma-asztalára
szerelt kálium-ferrocianid kristály C hasadási síkjára
estek. A kristály felülete függôleges volt, és
a spektrométer geometriai tengelye áthaladt rajta.
Kaye
mutatta ki, hogy az elegendôen gyors katódsugárnyalábbal
gerjesztett elemek karakterisztikus Röntgen-sugárzást
bocsájtanak ki. Vizsgálataihoz számos anyagot használt
targetként. A céltárgyakat evakuált csôben
elhelyezett kocsira erôsítette, és mágneses
berendezéssel állította a sugárzás irányába.
A készüléket a jelen munka céljaira módosítottuk.
A katódból érkezô nyalábot a target egy
kis felületére koncentráltuk, és keskeny függôleges
réssel ellátott platinalemezt tettünk közvetlenül
a bombázott rész elé. A csövet Gaede-féle
higanyszivattyúval evakuáltuk, néha cseppfolyós
levegôbe helyezett faszenet is használtunk a vízgôz
eltávolítására. A Röntgen-sugarak - az
ábrán S-sel jelzett résen áthaladva - egy 0,02
mm vastag alumíniumablakon léptek ki. A sugárzás
többi részét a csövet körülvevô
ólomdoboz nyelte el. A sugarak egy spektrométer prizma-asztalára
szerelt kálium-ferrocianid kristály C hasadási síkjára
estek. A kristály felülete függôleges volt, és
a spektrométer geometriai tengelye áthaladt rajta.